Liệu pháp NK được áp dụng điều trị như thế nào? Có điều gì cần lưu ý đối với liệu pháp NK
Hệ thống miễn dịch được coi là một cơ chế thiết yếu nhằm giám sát mức độ stress của khối u đối với sự phát triển của cấu trúc tế bào gây sinh ung thư, cũng như hỗ trợ việc xác định và loại trừ các khối u đã trưởng thành [1]. Mặc dù cơ chế miễn dịch kháng ung thư ban đầu được xác định là chủ yếu bằng trung gian miễn dịch bẩm sinh của các hệ thống miễn dịch khi phản ứng với các thụ thể đặc hiệu của khối u, song khả năng miễn dịch bẩm sinh, cũng như tế bào NK, đã đóng một vai trò quan trọng trong việc thích ứng nhanh với sự phát triển của tế bào [2].
Liệu pháp sử dụng tế bào NK để phục vụ cho việc điều trị các bệnh ung thư đã được chứng minh là có hiệu quả thông qua các thử nghiệm trên động vật cho đến các thử nghiệm lâm sàng trên cơ thể người. Tuy nhiên để áp dụng liệu pháp này thu lại hiệu quả cao cần phải hiểu rõ về tế bào NK và các tính năng của nó.
TẢI FILE PDF TẠI ĐÂY: Liệu pháp NK được áp dụng điều trị như thế nào Có điều gì cần lưu ý đối với liệu pháp NK
Tế bào NK là gì?
Tế bào miễn dịch NK (Natural killer cell – tế bào tiêu diệt tự nhiên) là một trong những thành phần quan trọng của hệ thống miễn dịch bẩm sinh và chúng là tuyến phòng thủ đầu tiên chống lại các tế bào ung thư phát triển bên trong cơ thể. Tế bào NK tuần hoàn khắp cơ thể có nhiệm vụ phát hiện, ngăn chặn các tác nhân gây hại như tế bào lạ, tế bào mang mầm bệnh, các loại vi khuẩn, virus và lập tức vô hiệu hóa các tác nhân đó, biến chúng thành vô hại mà không cần phải nhận các tín hiệu miễn dịch để hành động như các loại tế bào khác [3-6]. Nếu một người bị ốm thường xuyên, chúng ta có thể kết luận rằng số lượng tế bào NK của người này thấp và hiệu suất không hoạt động, do đó, hệ thống miễn dịch của họ không thể chống lại các chất lạ xâm nhập vào cơ thể.
Chức năng của tế bào NK và kích hoạt NK
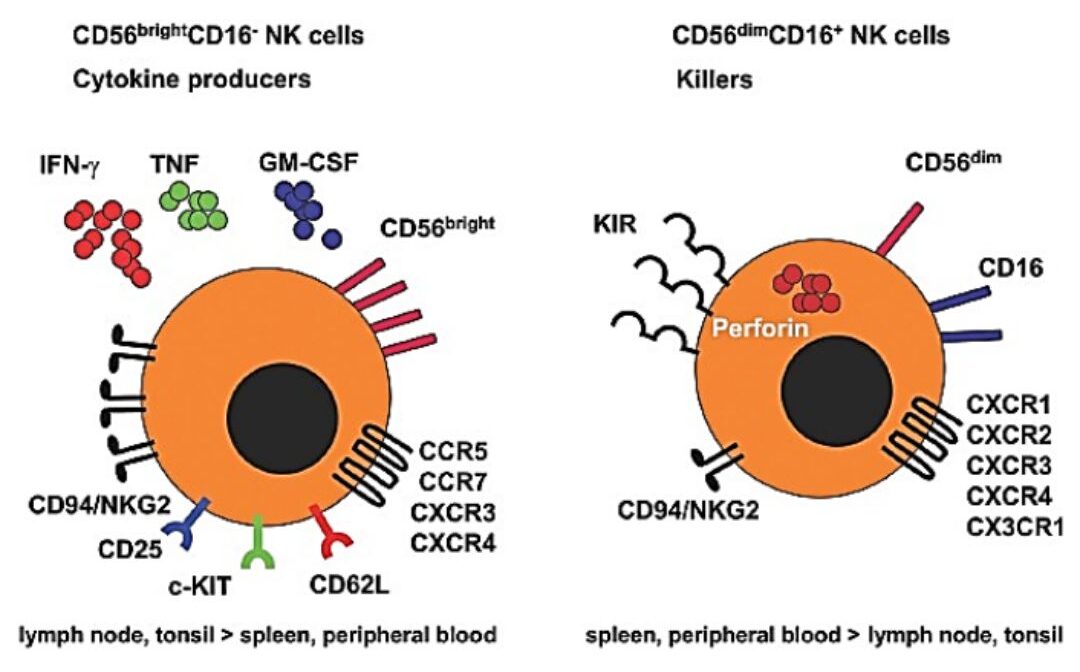
Các tế bào NK của con người có thể được chia thành các quần thể con CD56bright và CD56dim, và cả hai quần thể con này đều tham gia vào quá trình miễn dịch chống ung thư với vai trò chức năng riêng biệt [7]. Các tế bào NK CD56bright phân bố chủ yếu ở amidan, lá lách và hạch bạch huyết, và các tế bào NK cư trú ở mô chủ yếu là CD56bright (Hình 1).
Hình 1: Quần thể và các thụ thể trên tế bào NK ở người
Là chất trung gian của hệ thống miễn dịch bẩm sinh, các tế bào NK có hai chức năng chính là tác dụng gây độc tế bào và điều hòa miễn dịch. Không cần kích hoạt trước, các tế bào NK có thể nhận biết và tiêu diệt các tế bào bất thường bằng cách giải phóng perforin và granzyme [4,8]. Ngoài ra, việc kích thích các tế bào NK bằng các thụ thể kích hoạt killer (KARs) gây ra sự biểu hiện và giải phóng các phối tử chết (death ligands), bao gồm yếu tố hoại tử khối (TNFα), phối tử Fas (FasL) và phối tử gây ra quá trình chết theo chương trình liên quan đến TNF (TRAIL), kích hoạt con đường apoptotic [9].
Về cơ chế kích hoạt tế bào NK, NKG2D và DNAM-1 (CD226) là hai thụ thể kích hoạt phổ biến được biểu thị trên các tế bào NK. Các phối tử của NKG2D bao gồm các chất tương đồng MHC lớp I MICA/B và ULBP (protein liên kết với UL16 của cytomegalovirus) ở người [10]. Sau khi nhận ra các phối tử này, các thụ thể NKG2D thực hiện chức năng thông qua protein DAP10, protein này tổng hợp phosphatidylinositol-3 kinase và kích hoạt độc tính tế bào.
Đối với thụ thể DNAM-1, CD96 và TIGIT có thể được biểu hiện trên các tế bào NK và điều chỉnh tiêu cực đến hoạt động của tế bào NK, bao gồm hạn chế khả năng gây độc tế bào và hạn chế sản xuất IFN-γ. Đáng chú ý, sự biểu hiện của các phối tử DNAM-1 bởi các tế bào ung thư có liên quan đến tỷ lệ thấp của các phối tử NKG2D, có nghĩa là quá trình tiêu diệt qua trung gian tế bào NK được kích hoạt bởi con đường DNAM-1 hoặc NKG2D. Như vậy lựa chọn liệu pháp miễn dịch có liên quan đến kiểu hình bề mặt của tế bào ung thư [11].
Một thụ thể kích hoạt mạnh khác là CD16. Sau khi liên kết ngang với vùng Fc của kháng thể, CD16 kích hoạt khả năng gây độc tế bào phụ thuộc vào kháng thể (ADCC) chống lại các tế bào ung thư được phủ kháng thể [12]. ADCC được kích hoạt bởi một số kháng thể trị liệu nhận ra các kháng nguyên liên quan đến khối u với sự gia tăng xâm nhiễm tế bào ung thư, có thể dự đoán khả năng di căn ung thư và điều này chứng tỏ hiệu quả của tế bào NK trong miễn dịch thích ứng. Các thụ thể họ globulin miễn dịch (NKp46, NKp30 và NKp44) được gọi chung là các thụ thể gây độc tế bào tự nhiên và có liên quan đến việc nhận biết và phân giải các tế bào virus, vi khuẩn và tế bào ung thư. Trong số các thụ thể này, chỉ NKp44 được biểu hiện chọn lọc bởi các tế bào NK kích hoạt IL-2 trong khi NKp46 và NKp30 được biểu hiện bởi tất cả các tế bào NK. Các thụ thể này trực tiếp kích hoạt quá trình sản xuất cytokine và gây độc tế bào của tế bào NK [13].
Tế bào NK rất cần thiết để bảo vệ chống lại quá trình sinh ung thư
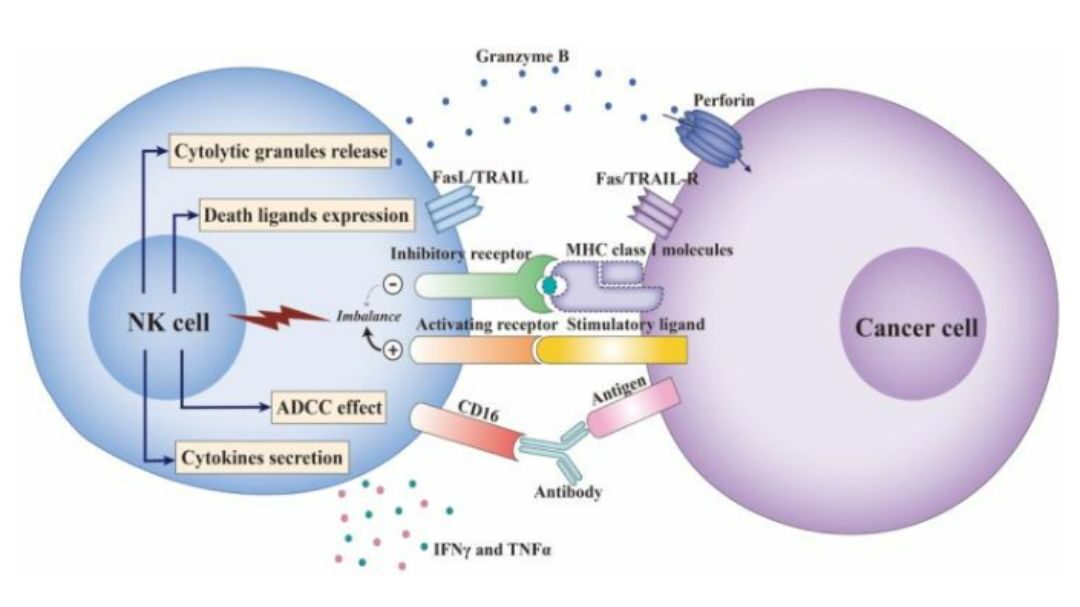
Ở những bệnh nhân mắc bệnh bạch cầu được ghép tế bào gốc đồng loại, tế bào NK là tế bào lympho đầu tiên xuất hiện và phản ứng trước khi tế bào T thực hiện chức năng của nó [14]. Ngoài ra, những người có mức độ gây độc tế bào tế bào NK cao hơn có tỷ lệ mắc ung thư thấp, chứng tỏ khả năng giám sát miễn dịch mạnh mẽ của tế bào NK [15]. Các quần thể con CD56dim cấu thành phần lớn các tế bào NK đang lưu thông trong máu, phổi và lá lách với khả năng gây độc tế bào mạnh hơn và khả năng đáp ứng cao hơn với sự kích thích của các tế bào ung thư. Mặc dù số lượng tương đối thấp, các tế bào NK CD56bright có khả năng sản xuất cytokine và chemokine mạnh mẽ để đáp ứng với sự kích thích của IL-12, IL-15 và IL-18. Hơn nữa, thông qua việc sản xuất IFN-γ và chemokine, tế bào NK thúc đẩy sự trưởng thành và kích hoạt tế bào đuôi gai, đại thực bào và tế bào T thực hiện chức năng chống ung thư của chúng (Hình 2) [16]. Các đặc tính điều hòa miễn dịch như vậy chứng minh vai trò thiết yếu của tế bào NK trong phản ứng miễn dịch sớm đối với quá trình sinh ung thư.
Hình 2: Chức năng của tế bào NK trong phản ứng với tế bào ung thư
Các tế bào NK rất cần thiết trong việc chống lại quá trình sinh ung thư, mặc dù chúng có khả năng xâm nhập kém và khả năng gây độc tế bào thấp hơn trong môi trường vi mô khối u (TME). Vì sự phát triển và tiến triển của bệnh ung thư có tương quan với sự rối loạn chức năng của các tế bào NK, nên việc tăng cường chức năng của các tế bào NK là cần thiết cho khả năng miễn dịch chống ung thư.
Liệu pháp tế bào NK và áp dụng trong lâm sàng
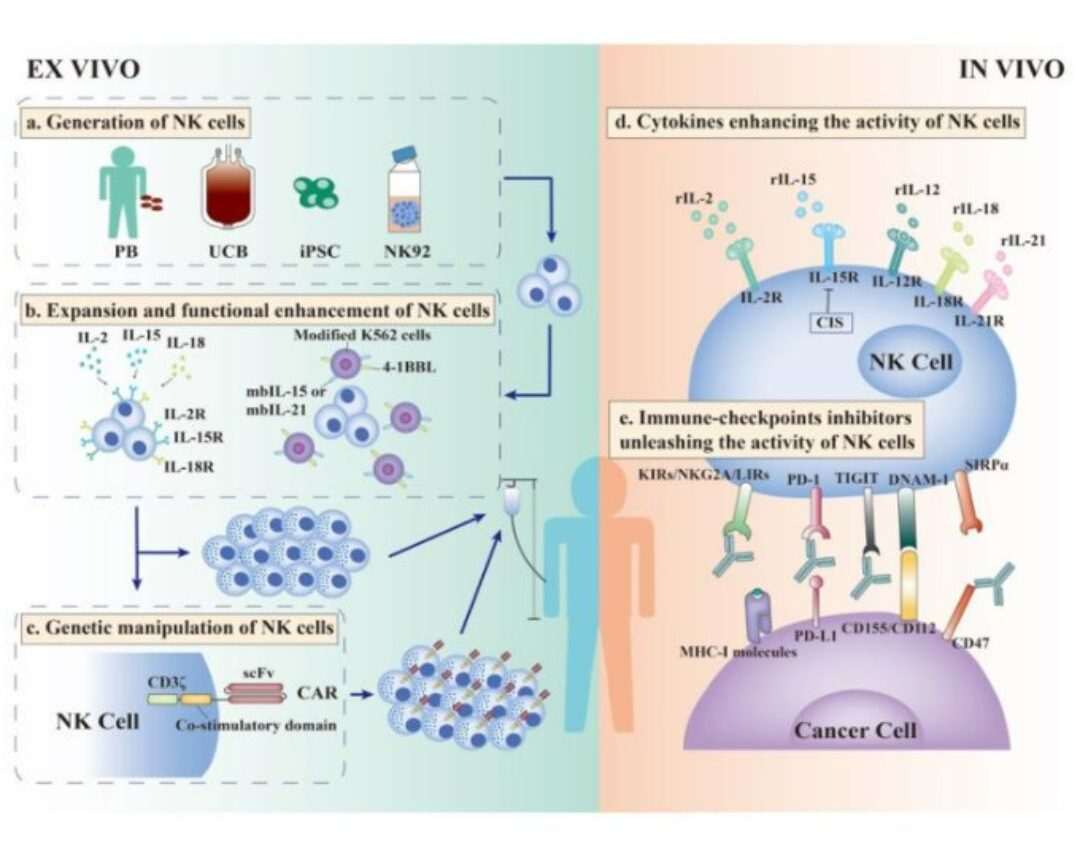
Tế bào NK rất cần thiết cho khả năng miễn dịch chống ung thư. Sự hiện diện của nhiều yếu tố ức chế trong môi trường vi mô khối u (TME) đã được chứng minh là ngăn chặn chức năng của các tế bào NK. Ngoài ra, các đặc điểm sinh học của tế bào NK và các kỹ thuật sửa đổi để cải thiện hiệu quả của liệu pháp tế bào NK cũng được thảo luận rộng rãi. Các thử nghiệm lâm sàng sử dụng liệu pháp tế bào NK đơn thuần hoặc kết hợp với các phương pháp khác để điều trị bệnh nhân ung thư đang diễn ra và cho thấy hiệu quả điều trị đầy hứa hẹn (Hình 3).
Liệu pháp truyền tế bào NK đồng loài được coi là một phương pháp khả thi, nhờ vào sự tiện lợi của việc tìm nguồn tế bào NK, không yêu cầu ức chế miễn dịch và nguy cơ thải ghép thấp. Tuy nhiên, số lượng tế bào NK lưu thông trong máu ngoại vi tăng lên không tạo ra đáp ứng điều trị như mong đợi, có lẽ là do sự ức chế của các phân tử HLA tự thân. Trong liệu pháp truyền tế bào NK đồng loài, sự không phù hợp giữa các KIRs (Các thụ thể giống như globulin miễn dịch của tế bào tiêu diệt) ức chế biểu hiện trên tế bào NK của người cho và các phối tử HLA của người nhận kích hoạt khả năng kết hợp của các tế bào NK.
Để tránh sự kháng miễn dịch của các tế bào NK dị hợp của người nhận, hóa trị liệu không gây sẹo lồi là cần thiết trước khi truyền tế bào NK đồng loài. Nghiên cứu đã chỉ ra rằng những bệnh nhân AML (Bạch cầu cấp tính dòng tế bào tủy xương) được truyền tế bào NK đơn bội sau khi dùng cyclophosphamide và fludarabine liều cao đạt được sự thuyên giảm hoàn toàn. Đáng chú ý, điều trị điều hòa làm suy giảm bạch huyết góp phần làm tăng đáng kể nồng độ IL-15 nội sinh cần thiết cho sự sản xuất và tồn tại của các tế bào NK của người cho [17].
Các cytokine tăng cường hoạt động của các tế bào NK trong in vivo. Cytokine có tác dụng điều hòa miễn dịch rất cần thiết để duy trì sự tồn tại, tăng sinh và trưởng thành của tế bào NK. Các cytokine này bao gồm IL-2, IL-15, IL-12, IL-21 và IL-18. IL-2 và IL-15 được nghiên cứu rộng rãi nhất. Chúng cần thiết để gây độc tế bào qua trung gian NKG2D và bài tiết IFN-γ. Do đó, chúng được sử dụng rộng rãi làm môi trường nuôi dưỡng trước khi truyền tế bào NK hoặc được làm chất dẫn truyền không ảnh hưởng đến tế bào NK. Mặc dù có những lo ngại về hiệu quả và độ an toàn, nhiều giải pháp khác nhau đang được nghiên cứu để tối ưu hóa hiệu quả điều trị [18,19].
Giải phóng các chất ức chế Immune-Checkpoint (điểm kiểm tra miễn dịch) để tăng hoạt động của các tế bào NK trong in vivo. Các tế bào ung thư ngăn chặn khả năng miễn dịch chống ung thư bằng cách nhắm mục tiêu các điểm kiểm soát miễn dịch được thể hiện trên các tế bào miễn dịch thông qua tiếp xúc giữa tế bào hoặc bài tiết exosome. Các chất ức chế điểm kiểm soát miễn dịch điển hình (PD-1/CTLA-4 ) đã được nghiên cứu và ứng dụng rộng rãi trong thực hành lâm sàng vì hiệu quả đáng kể của chúng trong việc làm giảm trạng thái ức chế của tế bào T. Các tế bào NK duy trì cân bằng nội mô chức năng thông qua các thụ thể kích hoạt và ức chế, đồng thời các tế bào ung thư điều chỉnh tăng các phối tử của các thụ thể ức chế để trốn tránh giám sát miễn dịch. Do đó, việc chặn các điểm kiểm soát ức chế là điều cần thiết để đảo ngược sự bất lực của các tế bào NK [20,21].
Hình 3: Các phương pháp để nâng cao hiệu quả của liệu pháp tế bào NK
Những lưu ý đối với liệu pháp miễn dịch tế bào NK
Từ những thử nghiệm có thể kết luận rằng liệu pháp NK rất cần thiết trong việc bảo vệ và chống lại các tác nhân gây bệnh ở người, trong đó có cả ung thư. Khi thực hiện liệu pháp tế bào NK, có một số điều cần lưu ý như sau:
- Chọn nguồn tế bào NK: Tế bào NK có thể được lấy từ bệnh nhân (từ máu hoặc tủy xương) hoặc từ nguồn khác như người hiến tặng. Quyết định chọn nguồn tế bào phụ thuộc vào tình trạng sức khỏe của bệnh nhân và các yếu tố khác nhau.
- Chuẩn bị môi trường thích hợp: Quá trình tách tế bào NK và phát triển chúng yêu cầu một môi trường phòng thí nghiệm chuyên nghiệp và phù hợp. Đảm bảo tuân thủ các quy định về vệ sinh và an toàn trong quá trình này.
- Đánh giá hiệu quả và an toàn: Trước khi sử dụng tế bào NK đã phát triển, cần kiểm tra hiệu quả và an toàn của chúng. Việc này thường bao gồm các thử nghiệm về hoạt động tế bào NK và kiểm tra sự có mặt của các chất gây viêm hay phản ứng phụ khác.
- Theo dõi sự phản ứng sau liệu pháp: Sau khi tiêm tế bào NK vào bệnh nhân, cần theo dõi sát sao sự phản ứng sau liệu pháp. Điều này có thể bao gồm theo dõi các dấu hiệu viêm nhiễm, phản ứng dị ứng hoặc tác động không mong muốn khác.
- Tích cực hỗ trợ miễn dịch: Khi thực hiện liệu pháp tế bào NK, cần đảm bảo rằng hệ miễn dịch của bệnh nhân đang trong tình trạng tốt nhất. Điều này có thể bao gồm việc sử dụng các phương pháp khác để tăng cường miễn dịch, chẳng hạn như chế độ ăn uống lành mạnh, tập thể dục đều đặn và kiểm soát căn bệnh cơ bản.
Lưu ý rằng các yếu tố chi tiết và quy trình cụ thể có thể khác nhau tùy theo quốc gia, cơ sở y tế và trạng thái bệnh lý của bệnh nhân. Vì vậy, rất quan trọng để thảo luận và tuân thủ hướng dẫn từ các chuyên gia về liệu pháp miễn dịch.
Tế bào NK là tế bào điều hòa miễn dịch quan trọng, đóng vai trò thiết yếu trong giám sát miễn dịch ung thư. Tuy nhiên, các chức năng và đặc điểm của tế bào NK bị suy giảm hoặc biến đổi trong quá trình ung thư tiến triển. Các tế bào NK bị ức chế chức năng trong TME do nhiều yếu tố ức chế miễn dịch, đặc biệt là TGFβ.
Do đó, ngày càng có nhiều nghiên cứu được tiến hành để tăng cường chức năng chống ung thư của tế bào NK thông qua các cytokine và kháng thể ngăn chặn. Hạn chế kỹ thuật cản trở sự phát triển của liệu pháp tế bào NK. Tuy nhiên, tiến bộ công nghệ đã tạo điều kiện thuận lợi cho việc tạo ra, mở rộng và biến đổi gen ex vivo của tế bào NK, do đó tăng cường các đặc tính chống ung thư của liệu pháp tế bào NK.
Hiệu quả điều trị của liệu pháp tế bào NK đơn thuần hoặc kết hợp với các phương pháp khác đã được chứng minh rộng rãi trong nhiều thử nghiệm lâm sàng, và các nghiên cứu tiền lâm sàng tiếp theo đang được tiến hành. Do đó, liệu pháp tế bào NK có thể là một lựa chọn điều trị đầy hứa hẹn cho bệnh ung thư.
Tài liệu tham khảo:
- Gonzalez, H., Hagerling, C., & Werb, Z. (2018). Roles of the immune system in cancer: from tumor initiation to metastatic progression. Genes & development, 32(19-20), 1267-1284.
- Marcus, A., Gowen, B. G., Thompson, T. W., Iannello, A., Ardolino, M., Deng, W., … & Raulet, D. H. (2014). Recognition of tumors by the innate immune system and natural killer cells. Advances in immunology, 122, 91-128.
- Freud, A. G., Mundy-Bosse, B. L., Yu, J., & Caligiuri, M. A. (2017). The broad spectrum of human natural killer cell diversity. Immunity, 47(5), 820-833.Smyth, M. J., Cretney, E., Kelly, J. M., Westwood, J. A., Street, S. E., Yagita, H., … & Hayakawa, Y. (2005). Activation of NK cell cytotoxicity. Molecular immunology, 42(4), 501-510.
- Rubnitz, J. E., Inaba, H., Ribeiro, R. C., Pounds, S., Rooney, B., Bell, T., … & Leung, W. (2010). NKAML: a pilot study to determine the safety and feasibility of haploidentical natural killer cell transplantation in childhood acute myeloid leukemia. Journal of clinical oncology, 28(6), 955.
- Böttcher, J. P., Bonavita, E., Chakravarty, P., Blees, H., Cabeza-Cabrerizo, M., Sammicheli, S., … & e Sousa, C. R. (2018). NK cells stimulate recruitment of cDC1 into the tumor microenvironment promoting cancer immune control. Cell, 172(5), 1022-1037.
- Bjorkstrom NK, Ljunggren HG, Michaelsson J. Emerging insights into natural killer cells in human peripheral tissues
- Wu, C., Li, B., Lu, R., Koelle, S. J., Yang, Y., Jares, A., … & Dunbar, C. E. (2014). Clonal tracking of rhesus macaque hematopoiesis highlights a distinct lineage origin for natural killer cells. Cell Stem Cell, 14(4), 486-499.
- Voskoboinik, I., Whisstock, J. C., & Trapani, J. A. (2015). Perforin and granzymes: function, dysfunction and human pathology. Nature Reviews Immunology, 15(6), 388-400.
- Martínez-Lostao, L., Anel, A., & Pardo, J. (2015). How do cytotoxic lymphocytes kill cancer cells?. Clinical cancer research, 21(22), 5047-5056.
- Long E.O., Kim H.S., Liu D., Peterson M.E., Rajagopalan S. Controlling natural killer cell responses: Integration of signals for activation and inhibition. Ann. Rev. Immunol. 2013;31:227–258. doi: 10.1146/annurev-immunol-020711-075005.
- Raulet, D. H., & Vance, R. E. (2006). Self-tolerance of natural killer cells. Nature Reviews Immunology, 6(7), 520-531.
- Nimmerjahn, F., & Ravetch, J. V. (2008). Fcγ receptors as regulators of immune responses. Nature Reviews Immunology, 8(1), 34-47.
- Barrow, A. D., Martin, C. J., & Colonna, M. (2019). The natural cytotoxicity receptors in health and disease. Frontiers in immunology, 10, 909.
- Minculescu, L., Marquart, H. V., Friis, L. S., Petersen, S. L., Schiødt, I., Ryder, L. P., … & Sengeloev, H. (2016). Early natural killer cell reconstitution predicts overall survival in T cell–replete allogeneic hematopoietic stem cell transplantation. Biology of Blood and Marrow Transplantation, 22(12), 2187-2193.
- Malmberg, K. J., Carlsten, M., Björklund, A., Sohlberg, E., Bryceson, Y. T., & Ljunggren, H. G. (2017, June). Natural killer cell-mediated immunosurveillance of human cancer. In Seminars in immunology (Vol. 31, pp. 20-29). Academic Press.
- Vivier, E., Tomasello, E., Baratin, M., Walzer, T., & Ugolini, S. (2008). Functions of natural killer cells. Nature immunology, 9(5), 503-510.
- Deng, Xuewen, Hiroshi Terunuma, Atsushi Terunuma, Tsubasa Takane, and Mie Nieda. “Ex vivo-expanded natural killer cells kill cancer cells more effectively than ex vivo-expanded γδ T cells or αβ T cells.” International immunopharmacology 22, no. 2 (2014): 486-491.
- Bergamaschi, C., Stravokefalou, V., Stellas, D., Karaliota, S., Felber, B. K., & Pavlakis, G. N. (2021). Heterodimeric IL-15 in cancer immunotherapy. Cancers, 13(4), 837.
- Bergamaschi, C., Pandit, H., Nagy, B. A., Stellas, D., Jensen, S. M., Bear, J., … & Pavlakis, G. N. (2020). Heterodimeric IL-15 delays tumor growth and promotes intratumoral CTL and dendritic cell accumulation by a cytokine network involving XCL1, IFN-γ, CXCL9 and CXCL10. Journal for immunotherapy of cancer, 8(1).
- Putz, E. M., Guillerey, C., Kos, K., Stannard, K., Miles, K., Delconte, R. B., … & Smyth, M. J. (2017). Targeting cytokine signaling checkpoint CIS activates NK cells to protect from tumor initiation and metastasis. Oncoimmunology, 6(2), e1267892.
- Deuse, T., Hu, X., Agbor-Enoh, S., Jang, M. K., Alawi, M., Saygi, C., … & Schrepfer, S. (2021). The SIRPα–CD47 immune checkpoint in NK cells. Journal of Experimental Medicine, 218(3).