Liệu pháp tế bào NK trong điều trị ung thư biểu mô tế bào gan
Gan là một cơ quan quan trọng của cơ thể con người. Tuy nhiên, hiện nay có rất nhiều người mắc các bệnh liên quan đến gan, trong đó ung thư biểu mô tế bào Gan (Hepatocellular Carcinoma – HCC) là một trong những nguyên nhân hàng đầu gây tử vong do ung thư trên toàn thế giới [1]. HCC thường là một biến chứng của xơ gan và tỷ lệ mắc cao nhất được báo cáo từ các nước đang phát triển. So với các loại ung thư khác như ung thư phổi, ung thư ruột kết và ung thư tuyến tiền liệt đã giảm trong những năm gần đây, thì tỷ lệ mắc HCC lại tăng dần theo từng năm [1]. Các yếu tố nguy cơ chính gây ra HCC bao gồm nhiễm HBV/HCV, nghiện rượu, viêm gan nhiễm mỡ không do rượu và bệnh tiểu đường [2].
TẢI FILE PDF TẠI ĐÂY: Liệu pháp tế bào NK trong điều trị ung thư biểu mô tế bào gan – PDF
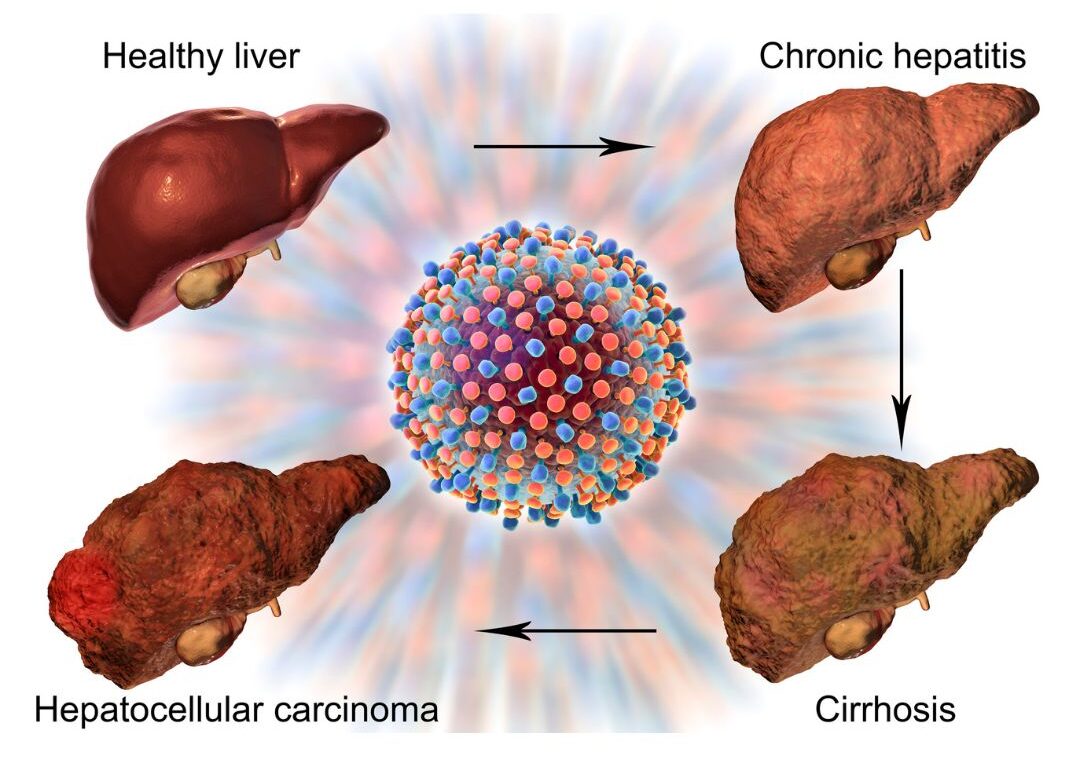
Các triệu chứng ở bệnh nhân HCC thường gặp là có biểu hiện đau bụng, sụt cân, sờ thấy khối u ở góc phần tư trên phải, và suy kiệt không rõ nguyên nhân. Ngoài ra, bệnh nhân có thể sốt và biểu hiện đầu tiên của ung thư biểu mô tế bào gan là cổ trướng dịch máu, sốc, hoặc viêm phúc mạc gây ra do khối u bị xuất huyết. Đôi khi, có thể xuất hiện tiếng gan cọ mạn sườn hoặc tiếng thổi động mạch (Hình 1).
Trong một số trường hợp, các biến chứng của chuyển hóa hệ thống cũng có thể xảy ra và gây ra hạ đường huyết, tăng hồng cầu, tăng calci huyết và tăng lipid máu. Những biến chứng này có thể được quan sát thông qua các dấu hiệu lâm sàng.
Hình1: Tình trạng Gan ở bệnh nhân HCC
Trong vài năm qua, các phương pháp điều trị cho bệnh nhân HCC đã được cải thiện đáng kể. Các phương pháp này bao gồm phẫu thuật cắt bỏ hoặc các phương pháp tiếp cận tại chỗ, ghép gan hoặc sử dụng các loại thuốc như sorafenib và lenvatinib cho bệnh tiến triển tốt. Tuy nhiên, vẫn có nhiều bệnh nhân không đáp ứng tốt với các phương pháp này hoặc mức độ hồi phục chậm. Tỷ lệ tử vong chung của HCC vẫn rất cao. Nghiên cứu gần đây chỉ ra rằng khả năng miễn dịch của bệnh nhân là yếu tố quan trọng trong việc kiểm soát các bệnh ung thư, kể cả HCC. Trong số các thành phần miễn dịch, tế bào giết tự nhiên (NK) chiếm một vai trò quan trọng.
Chúng chiếm 25% – 50% tổng số tế bào lympho gan và có thể giúp kiểm soát sự tiến triển của HCC. Số lượng tế bào NK trong máu và mô khối u của bệnh nhân HCC có mối tương quan tỉ lệ thuận với khả năng sống sót và tiên lượng của bệnh nhân. Hơn nữa, một nhóm các gen liên quan đến tế bào NK trong các mô HCC có liên quan tích cực đến thời gian sống sót kéo dài. Những phát hiện này cho thấy rằng các tế bào NK và sự tiến triển của HCC có liên quan chặt chẽ với nhau.
Suy giảm chức năng tế bào NK ở bệnh nhân HCC
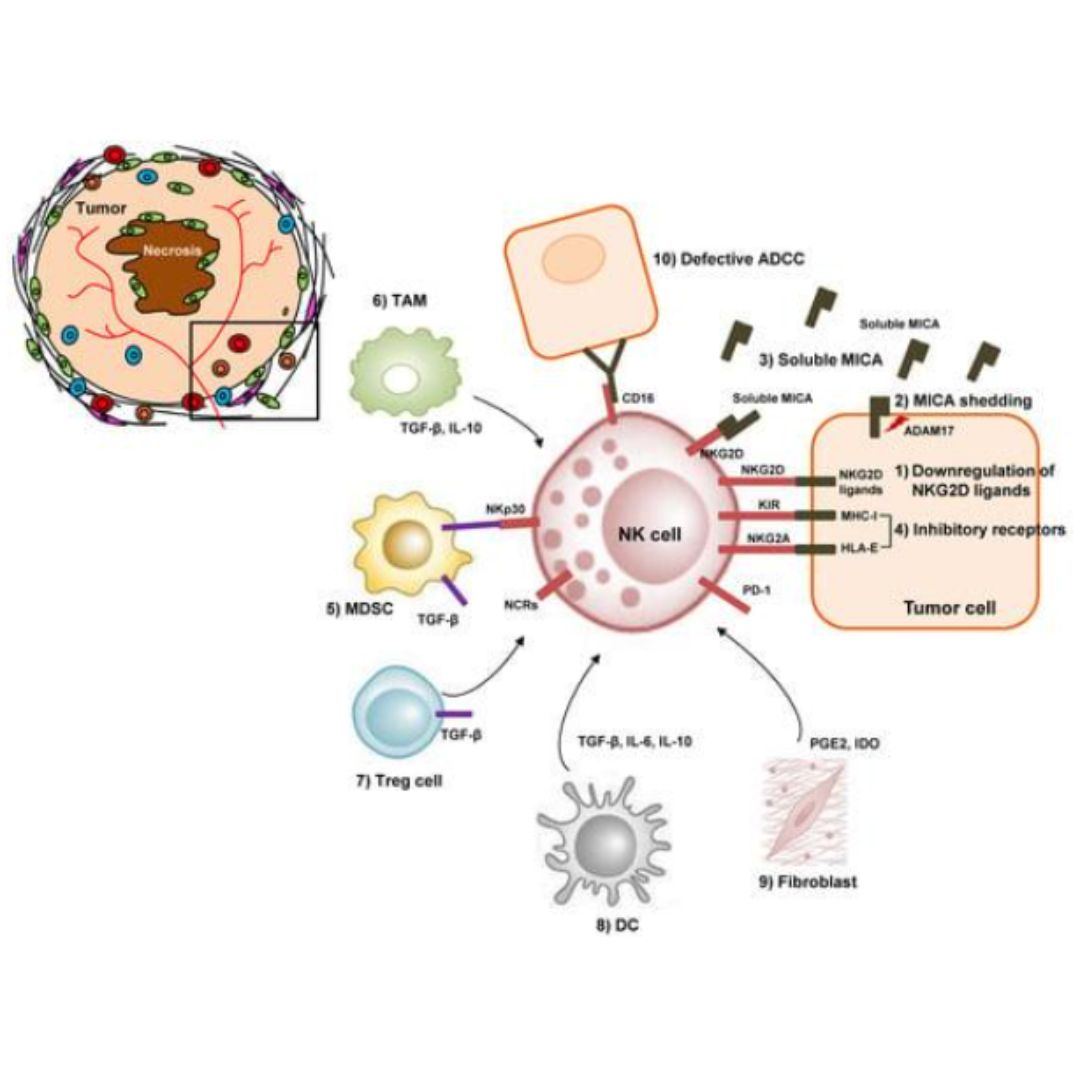
Ngày càng có nhiều bằng chứng cho thấy rằng sự rối loạn chức năng hoặc cạn kiệt tế bào NK tại các vị trí khối u của bệnh nhân HCC đã gây nên tình trạng nặng hơn của bệnh nhân ung thư gan. Một số nghiên cứu đã chỉ ra rằng các tế bào NK từ PBMC (tế bào đơn nhân máu ngoại vi) và TIL (tế bào lympho xâm nhập khối u) ở bệnh nhân HCC bị khiếm khuyết về khả năng gây độc tế bào và bài tiết cytokine so với tế bào NK từ người khỏe mạnh, và hoạt động của tế bào NK giảm có thể liên quan đến sự phát triển và xâm lấn của HCC [3]. Khiếm khuyết trong hoạt động của tế bào NK có tương quan tỉ lệ nghịch với tuổi của bệnh nhân, và bệnh nhân HCC có hoạt động của tế bào NK thấp hơn thường có biểu hiện xâm lấn tĩnh mạch hoặc tổn thương cả hai thùy [3].
Khả năng gây độc tế bào của tế bào NK từ PBMC và TIL của bệnh nhân HCC giảm đáng kể so với nhóm đối chứng là người khỏe mạnh. Việc sản xuất các hạt tế bào chất (granzyme A, granzyme B và perforin) và sự bài tiết IFN-γ của các tế bào NK từ PBMC cũng giảm đáng kể ở những bệnh nhân HCC giai đoạn tiến triển (giai đoạn II và III) so với những người khỏe mạnh. Hoạt động giảm tương tự cũng được tìm thấy trong các tế bào NK từ TIL so với NIL (tế bào lympho không xâm nhập khối u). Giảm đáng kể granzyme B và perforin cũng được ghi nhận khi bệnh nhân giai đoạn II được so sánh với bệnh nhân giai đoạn I. Hoạt động của tế bào NK giảm có liên quan đến việc tăng tế bào điều hòa CD4 + CD25 + T trong môi trường khối u của bệnh nhân HCC [4]. Các tế bào ức chế có nguồn gốc từ tủy (MDSC), bạch cầu đơn nhân hoặc đại thực bào và nguyên bào sợi có nguồn gốc từ HCC cũng kích hoạt rối loạn chức năng tế bào NK thông qua thụ thể NKp30, CD48/2B4 hoặc PGE 2 và IDO riêng biệt (Hình 2) [3,5,6].
Hình 2: Sự suy giảm chức năng tế bào NK trong vi môi trường khối u của HCC
Liệu pháp miễn dịch dựa trên tế bào NK cho bệnh nhân HCC
Sự phát triển và tiến triển của các khối u không chỉ phụ thuộc vào sự mất ổn định bộ gen bên trong của khối u mà còn là kết quả của sự đồng tiến hóa của hệ thống miễn dịch và các tế bào khối u. Vai trò quan trọng của các tế bào NK trong việc bảo vệ chống lại sự xâm nhập virus và hạn chế sự phát triển của các khối u đã được xác nhận. Sự phát triển mạnh khối u được quan sát thấy ở những con chuột thiếu NKG2D (một thụ thể kích hoạt trên tế bào NK), cung cấp bằng chứng quan trọng cho việc giám sát các khối u bởi tế bào NK và các thụ thể của chúng [7].
Do chiếm tỷ lệ cao và có các chức năng độc đáo của tế bào NK trong gan, chúng có tác dụng quan trọng đối với sự phát triển và tiến triển của HCC, đặc biệt là hạn chế nhiễm HBV hoặc HCV và ngăn ngừa bệnh tiến triển từ viêm gan mãn tính thành HCC [8,9]. Các tế bào NK tích tụ trong gan và có thể trực tiếp (hoặc gián tiếp thông qua việc sản xuất các cytokine) tiêu diệt các tế bào gan mang mầm bệnh, stressed hepatocytes và tế bào khối u. Các tế bào NK cũng có thể tiêu diệt các tế bào hình sao ở gan đã hoạt hóa (HSC), do đó làm giảm quá trình xơ hóa gan.
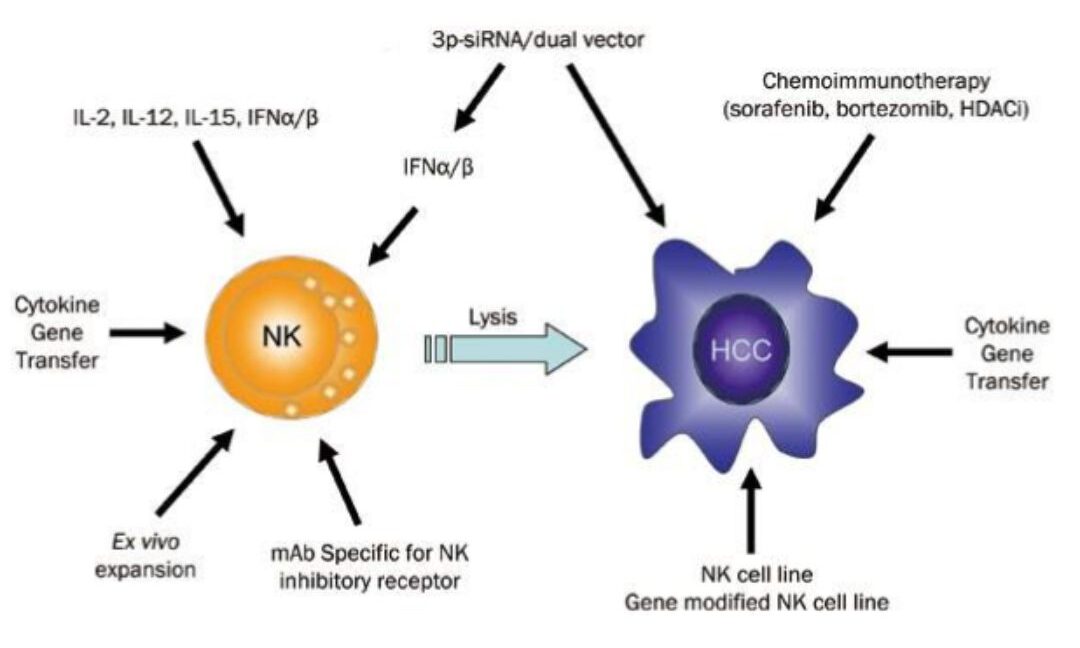
Theo đó, các tế bào NK đóng vai trò quan trọng trong việc không chỉ loại bỏ HBV hoặc HCV khỏi các tế bào gan bị nhiễm bệnh mà còn ngăn chặn sự phát triển của xơ hóa, xơ gan và HCC. Tuy nhiên, các chức năng của chúng (gây độc tế bào và sản xuất cytokine) bị gián đoạn ở những bệnh nhân nhiễm HBV/HCV kéo dài và trong quá trình biến đổi khối u. Do đó, liệu pháp miễn dịch dựa trên tế bào NK để khắc phục cơ chế rối loạn chức năng tế bào NK và tạo ra phản ứng miễn dịch tế bào NK hiệu quả đã được khai thác như một phương pháp điều trị đầy hứa hẹn. Các phương pháp trị liệu chủ yếu tập trung vào việc kích hoạt tế bào NK và đảo ngược rối loạn chức năng của tế bào NK, và đã cho thấy tiềm năng thú vị đối với liệu pháp miễn dịch HCC (Hình 3).
Hình 3: Liệu pháp miễn dịch dựa trên tế NK đối với ung thư biểu mô tế bào gan (HCC)
Sự cạn kiệt của các tế bào NK được phản ánh bởi khả năng gây độc tế bào và sản xuất cytokine bị suy giảm có thể là một dấu hiệu để tiên đoán và tiên lượng cho bệnh nhân HCC. Số lượng tuyệt đối của tế bào NK lưu hành và tế bào NK trong gan có mối tương quan tỷ lệ thuận với khả năng sống sót và tiên lượng của bệnh nhân HCC [10,11]. Ở người, cả tế bào NK trong và ngoài gan đều đại diện cho các tế bào quan trọng của hệ thống miễn dịch bẩm sinh của chúng ta và đóng vai trò chính trong phản ứng miễn dịch của cơ thể chống lại các tế bào bị nhiễm HBV hoặc HCV và sự phát triển của HCC [12] . Can thiệp trị liệu dựa trên thụ thể kích hoạt IL-15 của tế bào NK tác động đại diện cho một cách tiếp cận mới trong liệu pháp miễn dịch dựa trên tế bào của HCC [13].
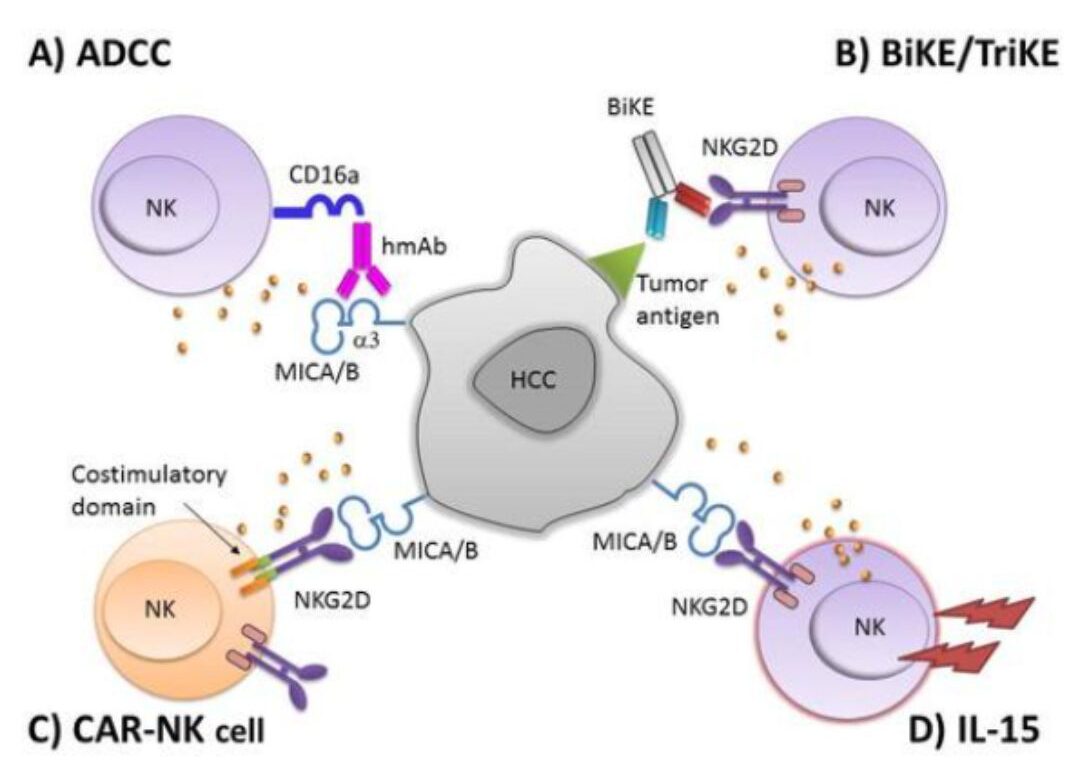
Các tế bào NK nhắm vào các tế bào khối u được kích hoạt bởi các kháng thể đơn dòng đặc hiệu cho các kháng nguyên liên quan đến khối u GPC-3 hoặc AFFP trên các tế bào khối u bằng cách làm trung gian ADCC và đây cũng sẽ là một chiến lược điều trị đầy hứa hẹn sau khi kích hoạt các tế bào NK bằng các cytokine như IL- 15 [13,14]. Các tế bào NK đã hoạt hóa được tạo ra từ máu ngoại vi của những người khỏe mạnh bằng cách sử dụng dòng tế bào K562-mb15-41BBL làm chất kích thích, gây độc tế bào cao đáng kể đối với các dòng tế bào HCC, cao hơn đáng kể so với các tế bào NK chưa được kích thích. Những kết quả này đảm bảo cho thử nghiệm lâm sàng về việc truyền tế bào NK đồng loại hoặc tế bào tự thân mở rộng ở những bệnh nhân bị HCC. Phẫu thuật bằng kỹ thuật áp đông kết hợp với liệu pháp tế bào NK dị sinh đã được chứng minh là cải thiện rõ rệt khả năng sống sót không tiến triển của bệnh nhân HCC giai đoạn tiến triển [15].
Hình 4: Các phương pháp trị liệu miễn dịch dựa trên NK cho bệnh nhân HCC
Khả năng trao đổi chất của các tế bào NK có một vai trò quan trọng trong việc giám sát khối u. Sự phân mảnh của ty thể trong các tế bào NK ở gan của bệnh nhân HCC có liên quan đến việc giảm độc tính tế bào và giảm số lượng tế bào NK, dẫn đến việc khối u tránh được sự giám sát của tế bào NK, dẫn đến khả năng sống sót giảm đi ở bệnh nhân HCC. Ức chế sự phân mảnh của ty thể đã cải thiện quá trình trao đổi. Việc ủ các tế bào NK từ những người khỏe mạnh với huyết tương giàu TGF-β (yếu tố chuyển đổi tăng trưởng β) từ bệnh nhân HCC có thể tái hấp thu sự suy giảm chức năng và chuyển hóa được dự đoán bởi việc biểu hiện gen và kiểu hình của bệnh nhân HCC.
Sự đối kháng TGF-β có thể khôi phục một phần các khiếm khuyết chức năng của tế bào NK, cho thấy rằng TGF-β trong số các phân tử khác có thể là mục tiêu phù hợp cho can thiệp trị liệu miễn dịch nhằm phục hồi chức năng của tế bào NK [16]. Những nghiên cứu này làm nổi bật cơ chế phản miễn dịch thông qua rối loạn chức năng của ty thể, từ đó có thể phát triển các phương pháp điều trị ung thư dựa trên tế bào NK. Qua các nghiên cứu trên có thể chỉ ra rằng việc khai thác khả năng miễn dịch chống khối u của tế bào NK thể hiện một phương pháp điều trị có tiềm năng mạnh mẽ đối với HCC, phụ thuộc vào tiến bộ kỹ thuật trong việc kích hoạt và mở rộng các tế bào NK.
Tình trạng hiện tại và định hướng tương lai của liệu pháp tế bào NK trong HCC
Liệu pháp nuôi dưỡng các tế bào NK đòi hỏi phải mở rộng ex vivo, và tính đặc hiệu in vivo đối với các tế bào khối u, và hoạt động tối đa và bền bỉ in vivo. Nguồn tế bào NK cho liệu pháp miễn dịch có thể là tế bào NK tự thân hoặc đồng loại, tế bào NK có nguồn gốc từ tế bào gốc và các dòng tế bào NK như dòng tế bào NK-92. Việc truyền các tế bào NK tự thân không cho thấy kết quả sống sót được cải thiện ở một số loại ung thư, bởi vì các tế bào này có hiệu quả thấp và có xu hướng tồn tại trong hệ tuần hoàn hơn là trong môi trường vi mô của khối u [11,17]. Do đó, truyền tế bào NK dị loại gần đây đang được sử dụng rộng rãi trong các thử nghiệm lâm sàng khác nhau. Hầu hết các trường hợp thử nghiệm tế bào NK dị loài đã được thực hiện bằng cách sử dụng các tế bào NK đơn bội HLA có hoặc không có cấy ghép tế bào gốc tạo máu dị loài (HSCT) [18].
Biến đổi gen là một lựa chọn khác để chuyển hướng chức năng của tế bào NK. Thao tác di truyền của các tế bào NK đã được chứng minh là rất khó khăn. Sự tải nạp virus đã được báo cáo là có liên quan đến mức độ biểu hiện rất thấp của các gen được chèn vào và các tác động có hại đối với khả năng tồn tại của tế bào trong các tế bào NK. Sự tối ưu hóa gần đây của quá trình tải nạp virus để chuyển đổi gen hiệu quả đã được chứng minh là thúc đẩy sự tương tác và hoạt động của các khối u và tế bào NK.
Đầu tiên, nó có thể được thực hiện để biểu hiện các gen chuyển của cytokine. Chức năng của tế bào NK được tăng cường bằng cách biểu hiện các gen chuyển của cytokine như IL-15, IL-2 hoặc IL-12 [18]. Liệu pháp gen với adenovirus biểu hiện IL-12 chống lại HCC chỉnh hình trong mô hình chuột, cho thấy khả năng kiểm soát đáng kể sự phát triển của khối u. Việc chuyển gen IL-12 vào trong khối u trong mô hình HCC của chuột đã ức chế sự di căn và sự phát triển của khối u.
Tế bào NK đóng vai trò quan trọng trong việc loại bỏ vius viêm gan B hoặc C và ngăn chặn sự phát triển của xơ gan và ung thư gan. Những phương pháp điều trị chống HCC dựa trên tế bào NK đang được quan tâm ngày càng nhiều. Tuy nhiên, hầu hết các nỗ lực đang được khám phá trên các mô hình động vật hoặc một ít trong các thử nghiệm lâm sàng diễn ra trên người. Việc đánh giá tác dụng chống khối u lâu dài và tính an toàn cần được nghiên cứu thêm. Sự hiểu biết về khả năng nhận biết khối u của các tế bào NK trên bệnh nhân HCC sẽ mang lại những hiểu biết có giá trị cho việc điều trị HCC. Việc lựa chọn các nguồn tế bào NK đặc hiệu là rất quan trọng để mang lại phương pháp điều trị HCC thành công. Liệu pháp miễn dịch dựa trên các nguồn tế bào NK cụ thể (đặc biệt là các tế bào NK đặc hiệu cho gan) có thể là một cách tiếp cận hấp dẫn đối với bệnh nhân HCC. Điều quan trọng là các phương pháp kết hợp liệu pháp miễn dịch dựa trên tế bào NK với hóa trị liệu thông thường hoặc nhiều liệu pháp điều trị khác sẽ mang lại nhiều hy vọng cho những bệnh nhân HCC.
Tài liệu tham khảo
- Siegel, R. L., Miller, K. D., & Jemal, A. (2017). Cancer statistics, 2017. Ca Cancer J Clin, 67(1), 7-30.
- El–Serag, H. B., & Rudolph, K. L. (2007). Hepatocellular carcinoma: epidemiology and molecular carcinogenesis. Gastroenterology, 132(7), 2557-2576.
- Hoechst, B., Voigtlaender, T., Ormandy, L., Gamrekelashvili, J., Zhao, F., Wedemeyer, H., … & Korangy, F. (2009). Myeloid derived suppressor cells inhibit natural killer cells in patients with hepatocellular carcinoma via the NKp30 receptor. Hepatology, 50(3), 799-807.
- Cai, L., Zhang, Z., Zhou, L., Wang, H., Fu, J., Zhang, S., … & Wang, F. S. (2008). Functional impairment in circulating and intrahepatic NK cells and relative mechanism in hepatocellular carcinoma patients. Clinical immunology, 129(3), 428-437.
- Wu, Y., Kuang, D. M., Pan, W. D., Wan, Y. L., Lao, X. M., Wang, D., … & Zheng, L. (2013). Monocyte/macrophage‐elicited natural killer cell dysfunction in hepatocellular carcinoma is mediated by CD48/2B4 interactions. Hepatology, 57(3), 1107-1116.
- Li, T., Yang, Y., Hua, X., Wang, G., Liu, W., Jia, C., … & Chen, G. (2012). Hepatocellular carcinoma-associated fibroblasts trigger NK cell dysfunction via PGE2 and IDO. Cancer letters, 318(2), 154-161.
- Li, T., Yang, Y., Hua, X., Wang, G., Liu, W., Jia, C., … & Chen, G. (2012). Hepatocellular carcinoma-associated fibroblasts trigger NK cell dysfunction via PGE2 and IDO. Cancer letters, 318(2), 154-161.
- Tian, Z., Chen, Y., & Gao, B. (2013). Natural killer cells in liver disease. Hepatology, 57(4), 1654-1662.
- Sui, Q., Zhang, J., Sun, X., Zhang, C., Han, Q., & Tian, Z. (2014). NK cells are the crucial antitumor mediators when STAT3-mediated immunosuppression is blocked in hepatocellular carcinoma. The Journal of Immunology, 193(4), 2016-2023.
- Sun, C., Sun, H. Y., Xiao, W. H., Zhang, C., & Tian, Z. G. (2015). Natural killer cell dysfunction in hepatocellular carcinoma and NK cell-based immunotherapy. Acta Pharmacologica Sinica, 36(10), 1191-1199.
- Liu, P., Chen, L., & Zhang, H. (2018). Natural killer cells in liver disease and hepatocellular carcinoma and the NK cell-based immunotherapy. Journal of Immunology Research, 2018.
- Nomura, M., Tsuge, M., Uchida, T., Hiraga, N., Kurihara, M., Tsushima, K., … & Chayama, K. (2018). CTL‐associated and NK cell‐associated immune responses induce different HBV DNA reduction patterns in chronic hepatitis B patients. Journal of Viral Hepatitis, 25(12), 1555-1564.
- Mantovani, S., Oliviero, B., Lombardi, A., Varchetta, S., Mele, D., Sangiovanni, A., … & Mondelli, M. U. (2019). Deficient natural killer cell NKp30‐mediated function and altered NCR3 splice variants in hepatocellular carcinoma. Hepatology, 69(3), 1165-1179.
- Mantovani, S., Oliviero, B., Varchetta, S., Mele, D., & Mondelli, M. U. (2020). Natural killer cell responses in hepatocellular carcinoma: implications for novel immunotherapeutic approaches. Cancers, 12(4), 926.
- Lin, M., Liang, S., Wang, X., Liang, Y., Zhang, M., Chen, J., … & Xu, K. (2017). Cryoablation combined with allogenic natural killer cell immunotherapy improves the curative effect in patients with advanced hepatocellular cancer. Oncotarget, 8(47), 81967.
- Zecca, A., Barili, V., Canetti, D., Regina, V., Olivani, A., Carone, C., … & Missale, G. (2020). Energy metabolism and cell motility defect in NK-cells from patients with hepatocellular carcinoma. Cancer Immunology, Immunotherapy, 69, 1589-1603.
- Parkhurst, M. R., Riley, J. P., Dudley, M. E., & Rosenberg, S. A. (2011). Adoptive Transfer of Autologous Natural Killer Cells Leads to High Levels of Circulating Natural Killer Cells but Does Not Mediate Tumor RegressionNK Adoptive Transfer in Cancer Patients. Clinical Cancer Research, 17(19), 6287-6297.
- Lim, O., Jung, M. Y., Hwang, Y. K., & Shin, E. C. (2015). Present and future of allogeneic natural killer cell therapy. Frontiers in immunology, 6, 286. Lim, O., Jung, M. Y., Hwang, Y. K., & Shin, E. C. (2015). Present and future of allogeneic natural killer cell therapy. Frontiers in immunology, 6, 286.