Liệu pháp tế bào NK trong hỗ trợ sinh sản (IVF)
Vô sinh là tình trạng mà các cặp vợ chồng không thể mang thai một cách tự nhiên sau 12 tháng quan hệ thình dục đều đặn và không sử dụng biện pháp phòng tránh thai (1). Vô sinh có thể xảy ra cho các cặp vợ chồng chưa từng có con hoặc đã từng có con nhưng bị sảy thai nhiều lần hoặc thai ngoài tử cung. Thế giới hiện có khoảng từ 48,5 đến 72,4 triệu cặp vợ chồng bị vô sinh. Tỉ lệ này chiếm 12,8% đến 17,5% trong số những người đang trong độ tuổi sinh sản và cao hơn trong các khu vực như Châu Mỹ, Châu Âu, Tây Thái Bình Dương và Châu Phi (2). Công nghệ hỗ trợ sinh sản (Asisted reproductive technology, ART) được áp dụng để điều trị cho các cặp vợ chồng bị vô sinh hoặc hiếm muộn.
TẢI FILE PDF TẠI ĐÂY: Liệu pháp tế bào NK trong hỗ trợ sinh sản (IVF) – PDF
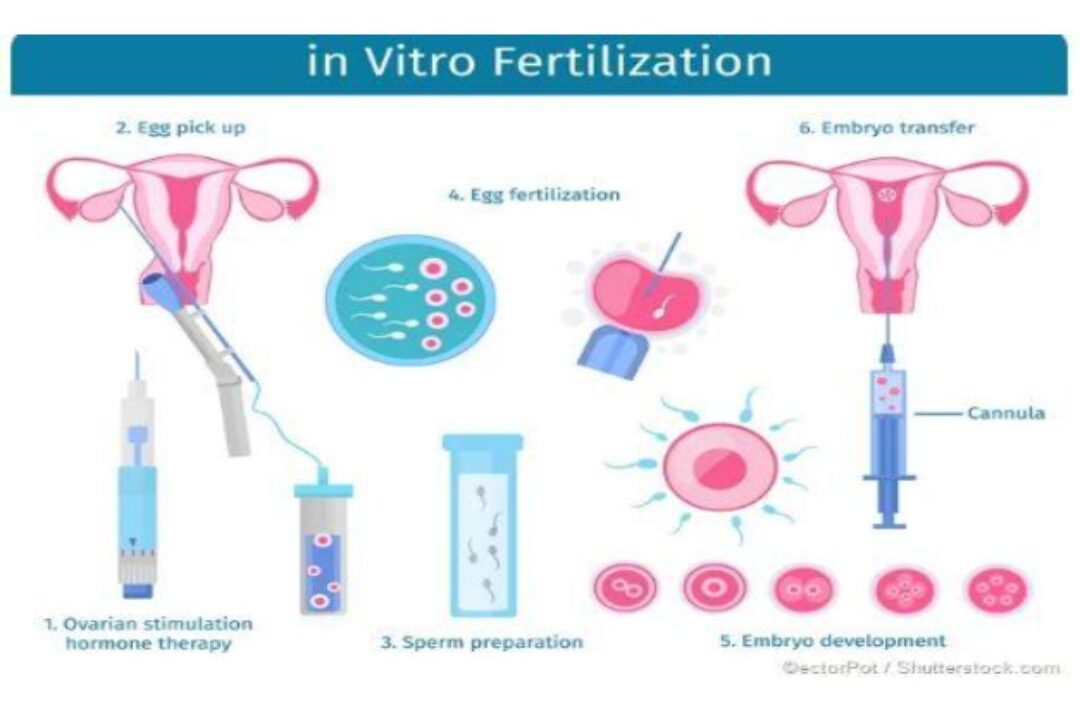
ART được xác định là bất kì phương pháp điều trị liên quan tới việc xử lý trứng và phôi (3). Thụ tinh trong ống nghiệm (In Vitro Fertiliaztion, IVF) là hình thức phổ biến nhất của ART. IVF là thao tác giúp trứng và tinh trùng được tụ tinh trong môi trường ngoai vi, phôi thai sau khi được hình thành sẽ được nuôi một thời gian ngắn trước khi chuyển lại vào tử cung người mẹ để tiếp tục phát triển (5) (Hình 1). Ở Mỹ, từ năm 2015 đến 2019 có khoàng 12% phụ nữ từ độ tuổi 15-49 phải can thiệp ART để có thai. Có khoảng 3% số trẻ em được sinh ra năm 2020 tại Mỹ thông qua ART (4). Việc rối loạn điều hòa miễn dịch là một trong những nguyên nhân gây ra thất bại làm tổ nhiều lần (RIL) và sảy thai liên tiếp (RPL) ở các bệnh nhân làm IVF (6).
Tế bào giết tự nhiên (Natural Killer Cell, NK) chiếm 70% trong tổng số tế bào miễn dịch ở nội mặc tử cung ở giai đoạn thể hoàng ở chu kì kinh nguyệt và trong 3 tháng đầu của thai kì, vì vậy các nghiên cứu gầy đây đã đánh giá vai trò tế bào NK trong việc tăng tỉ lệ thành công của IVF (7).
Hình 1: Quá trình thụ tinh trong ống nghiệm (IVF)
Tế bào NK và vai trò tế bào NK trong quá trình mang thai
Trong quá trình mang thai, hệ miễn dịch của người mẹ trải qua các thay đổi miễn dịch tương ứng với các giai đoạn trong quá trình mang thai như quá trình thụ tinh, làm tổ, mang thai và sinh nở. Phôi thai sau khi được thụ tinh sẽ di chuyển hoặc được cấy vào tử cung người mẹ (IVF) (8). Lớp tế bào lá nuôi phát triển quanh phôi nang 1 đến 2 ngày sau làm tổ và biệt hóa thành hai dòng tế bào: Tế bào nguyên bào nuôi ngoài lông nhau (extravillous trophoblasts – EVTs) có khả năng xâm nhâp vào niêm mặc tử cung tạo thuận lợi cho việc làm tổ và giữ chặt của rau thai, thứ hai là dòng hợp bào lá nuôi có khả năng sản sinh ra chorionic gonadotropin (hCG) vào ngày thứ 10 và các hormone lá nuôi khác ngay sau đó cũng như giúp đỡ trao đổi chất (9). Các sự kiện này trong thai kì là các quá trình viêm và cần có sự cân bằng giữa các yếu tố kích thích và ức chế viêm để giúp cho việc tái tạo các mô trong tử cung, thuận lợi cho phát triển của thai nhi và quá trình sinh nở được thuận lợi (10). Các tế bào giết tự nhiên NK đóng vai trò quan trọng trong việc bắt đầu và giải quyết tình trạng viêm nhiễm và chúng được phát hiện trong tất cả các giai đoạn của thai kì.
Tế bào NK là một phần của hệ miễn dịch tự nhiên, chúng có khả năng nhận biết và tiêu diệt các tế bào lạ như thế tào virus hoặc ung thư bằng khả năng gây độc khi tiết ra các perofin, granzyme là các protien gây độc và lysome phân giải tế bào đích (11). Để phát hiện ra các tế bào lạ, trên bề mặt tế bào NK có các thụ thể kích hoạt và ức chế giúp tương tác với các phối tử đặc hiệu của chúng trên tế bào đích, các thụ thể này thường là các phân tử MHC-I có mặt trên tất cả các loại tế bào của cơ thể. Ở các tế bào ung thư, các phân tử MHC-I thường có biêu hiện mất cân bằng ít hoặc tăng lên, dựa vào sự thiếu vắng của các phân tử này mà các tín hiệu ức chế/khích hoạt từ các thụ thể trên tê bào NK bị thay đổi và cho phép tế bào NK gây độc các tế bào này (12). Ngoài khả năng gây độc, tế bào NK còn có khả năng tiết ra các interferon (IFN)-γ và các cytokine điều hòa miễn dịch (13). Đặc trưng của tế bào bào NK là có sự biểu hiện của CD56, quần thể tế bào NK được chia hai loại là CD56dim and CD56bright (12).
Tế bào NK trong tử cung
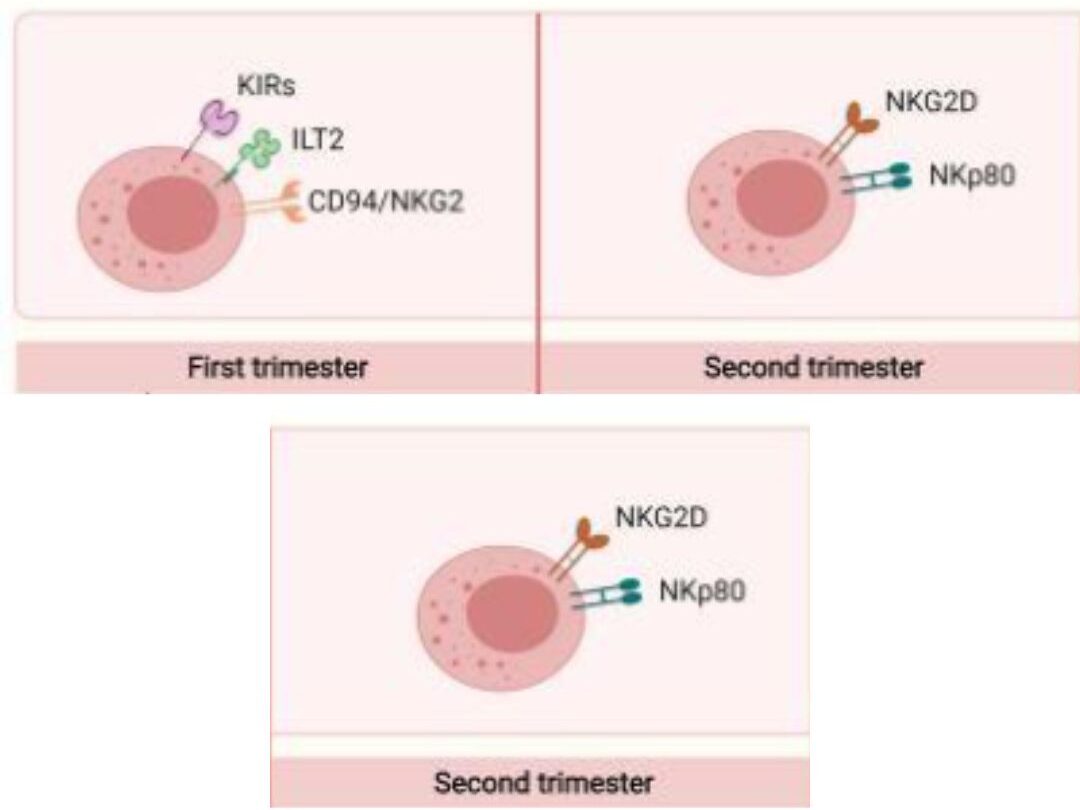
Tế bào NK chiếm 70% tổng số tế bào miễn dịch tại niêm mặc tử cung trong giai đoạn hoàng thể và trong 3 tháng đầu của thai kì (14). Các tế bào NK trong tử cung (uNK) được phân biệt dựa trên chỉ thị CD49a, chúng có thấy sự biểu hiện cao của các thụ thể như KIR (killer cel limmunoglobulin-like receptor) như: KIR2DS1, KIR2DS4, KIR2DL1, KIR2DL2 và KIR2DL3 có phối tử là các thụ thể kháng nguyên bạch cầu (HLA-C) trên người, ILTR2 (Leukocyte Immunoglobulin-Like Receptor B) có phối tử là HLA-G. Các phân tử HLA-C và HLA-G này được biểu hiện chủ yếu trên các tế bào lá nuôi từ phôi thai (Hình 2).
Điều này cho thấy tế bào uNK giảm khả năng gây độc giúp cho xự xâm lấn của EVT xâm lấn niêm mạc tử cung tái tạo mạch máu và duy trì môi trường dung nạp miễn dịch cục trong quá trình làm tổ (15). Đây là quá trình rất quan trọng để hình thành nhau thai, việc quá trình này bị ảnh hưởng có thể dẫn đến hiện tượng sảy thai nhiều lần, tiền sản dật và thi nhi chậm phát triển (16). uNK có thể điều hòa sự xâm lấn của tế bào EVT bằng cách tiết ra các cytokine IL-8, INF-g, IP-10 giúp làm châm quá trình chết theo chu trình của các tế bào này giúp tăng cường sự xâm lấn.
Ngược lại, sự xâm lấn quá mức của EVT tại tử cung cũng gây nguy hiểm cho phôi thai và mẹ, các cytokine TNF-a, TGF-b và IFN-g do uNK tiết ra có khả năng ức chế sự xâm lấn quá mức của EVT trong giai đoạn này (17). Các tế bào T-helper (Th17) là dòng tế bào quan trọng của dòng tế bào Th gây viêm, việc dư thừa Th17 trực tiếp gây ra sảy thai (18). Các tế bào NK CD56bright có thể làm giảm các tế bào Th17 bằng cách tiết ra IFN-g để thích đẩy quá trình dung nạp miễn dịch qua đó tăng khả năng mang thai thành công (19). Vai trò của tế bào NK trong 3 tháng đầu thai kì là đặc biệt quan trọng, chúng duy trì khả năng tồn tại phôi thai trong tử cung người mẹ hoặc cũng có thể đào thải chúng nếu co ựu mất cân bằng miễn dịch. Chính vị vậy, ở các bệnh nhân bị sảy thai nhiều lần và IVF thất bại do RIL được định hướng sử dụng các liệu pháp miễn dịch đích là các tế bào uNK, qua đó giúp tăng khả năng mang thai.
Hình 2: Một số thụ thể ức chế, kích hoạt của tế bào uNK trong các giai đoạn thai kỳ
Liệu pháp miễn dịch trong hỗ trợ sinh sản
Khoảng 50% trường hợp sảy thai liên tiếp (RPL) có nguyên nhân chủ yếu là do bất thường nhiễm sắc thể, rối loạn nội tiết, dị tật tử cung và nhiễm trùng (20). Nguyên nhân của 50% trường hợp còn lại không được biết và những trường hợp như vậy được gọi là “RPL không giải thích được” (uRPL). Những trường hợp không rõ nguyên nhân này có liên quan đến sự bất hòa về miễn dịch (21). Với bằng chứng về biểu hiện KIR2DL4 và HLA-G thấp hơn trên EVT ở bệnh nhân RPL, dẫn đến làm giảm quá trình xâm nhập EVT vào niêm mạc tử cung và giảm sự hình thành mạch máu trong quá trình làm tổ (22).
Thất bại làm tổ nhiều lần (recurrent implantation failure – RIF) được định nghĩa là không đạt được mang thai lâm sàng sau khi chuyển ít nhất bốn phôi chất lượng cao trong tối thiểu ba chu kỳ IVF ở một phụ nữ dưới 40 tuổi. Có khoảng 10% bệnh nhận bị RIF khi thực hiện IVF (23). Các tế bào uNK là dòng tế bào chính có mặt tại thời điểm chuyển phôi, vì vậy, các nghiên cứu gần đây cho thấy mức độ hoạt động tế bào uNK ảnh hưởng đến khả năng chuyển phôi thành công.
Ramos-Medina và cộng sự đã sử dụng Globulin miễn dịch tiêm tĩnh mạch (IVIG) là một chất có khả năng ức chế miễn dịch, làm giảm số lượng tế bào Th1 (nguyên nhân gây ra sảy thai), ức chế sản xuất kháng thể của tế bào B để điều trị cho 82 bệnh nhân sẩy thai liên tiếp (recurrent miscarriage – RM) và 80 bệnh nhân RIF với liều dùng 400mg/kg/3 tuần lần trong 3 tháng đầu với RPL và ngày thứ 15, sau 3 tuần một với liều lượng 200mg/kg đến tuần 35. Kết quả cho thấy tỉ lệ mang thai và sinh nở thành công ở nhóm sử đụng IVIG tăng đáng kể, kết quả cho thấy giảm hoạt động các tế bào pNK và uNK.
Tăng biểu hiện các thụ thể ức chế và giảm biểu hiện ở tế bào uNK ở nhóm bệnh nhân này (24). Tương tự Ahmadi và cộng sự năm 2019 đã sử dụng IVIG) để điều trị cho 38 bệnh nhân bị RM (>3 lần sảy thai) tuổi từ 18 đến 40 với liều dùng 400mg/kg/4 tuần cho đến tuần thứ 30 thai kì. Kết quả cho thấy ở các bệnh nhân có sử dụng IVIG, khả năng gây độc củ tế bào NK giảm đi đáng kể và tăng khả năng mang thai thành công (25). Nghiên cứu Dakhly và cộng sự, sử dụng intralipid, một chất có khả năng ức chế khả năng gây độc của tế bào uNK trên các tế bào EVT để điều trị cho 144 bệnh nhân bị RPL và RIF.
Intralipid được pha loãng 20% trong 250ml nước muối, truyền trong ngày lấy trứng và lặp lại 1 tuần sau chuyển phôi và sau đó 52 ngày từ ngày chuyển phôi. Két quả cho thấy sự hoạt động của tế bào uNK giảm đáng kể ở các bệnh nhân dùng intralipid, có 84/144 bệnh nhân mang thai thành công sau khi điều trị (26).
Mặc dù cơ sở để cung cấp liệu pháp miễn dịch trong RM/RIF bắt nguồn từ lý thuyết rằng hệ thống miễn dịch của người mẹ có thể tác động tiêu cực đến nguyên bào nuôi của thai nhi do sự mất cân bằng trong các tập hợp con của tế bào hỗ trợ T (Th1/Th2), suy giảm chức năng điều tiết T hoặc gia tăng tiền viêm nhiễm. Chức năng Th17 lên đến đỉnh điểm trong quá trình uNK bị kích hoạt quá mức (27). Các liệu pháp miễn dịch tế bào NK trong và trước giai đoạn thai kỳ cần đánh giá nhiều hơn về mức độ an toàn và hiệu quả nhưng chúng cũng là hướng đi mới cho hỗ trợ sinh sản nhằm điều trị cho các trường hợp RPL, RIL.
Tài liệu tham khảo
1.Eisfeld, J. (2014). International statistical classification of diseases and related health problems. Transgender Studies Quarterly, 1(1-2), 107-110.
2.Njagi, P., Groot, W., Arsenijevic, J., Dyer, S., Mburu, G., & Kiarie, J. (2023). Financial costs of assisted reproductive technology for patients in low-and middle-income countries: a systematic review. Human reproduction open, 2023(2), hoad007.
3.https://www.cdc.gov/art/whatis.html
4.Sunderam, S., Zhang, Y., Jewett, A., Mardovich, S., & Kissin, D. M. (2022). State-specific assisted reproductive technology surveillance, United States 2020 data brief.
5.Or, Y., Dar, S., & Shoham, Z. (2019). Journey of Human Gametes In Vitro: 1978 to 2018. In Vitro Fertilization: A Textbook of Current and Emerging Methods and Devices, 1-6.
6.Makrigiannakis, A., Petsas, G., Toth, B., Relakis, K., & Jeschke, U. (2011). Recent advances in understanding immunology of reproductive failure. Journal of reproductive immunology, 90(1), 96-104.
7.Moffett, A., & Shreeve, N. (2015). First do no harm: uterine natural killer (NK) cells in assisted reproduction. Human reproduction, 30(7), 1519-1525.
8.Gellersen, B., & Brosens, J. J. (2014). Cyclic decidualization of the human endometrium in reproductive health and failure. Endocrine reviews, 35(6), 851-905.
9.Knöfler, M., Haider, S., Saleh, L., Pollheimer, J., Gamage, T. K., & James, J. (2019). Human placenta and trophoblast development: key molecular mechanisms and model systems. Cellular and Molecular Life Sciences, 76, 3479-3496.
10.Yockey, L. J., & Iwasaki, A. (2018). Interferons and proinflammatory cytokines in pregnancy and fetal development. Immunity, 49(3), 397-412.
11.Voskoboinik, I., Whisstock, J. C., & Trapani, J. A. (2015). Perforin and granzymes: function, dysfunction and human pathology. Nature Reviews Immunology, 15(6), 388-400.
12.Vivier, E., Tomasello, E., Baratin, M., Walzer, T., & Ugolini, S. (2008). Functions of natural killer cells. Nature immunology, 9(5), 503-510.
13.Zitti, B., & Bryceson, Y. T. (2018). Natural killer cells in inflammation and autoimmunity. Cytokine & Growth Factor Reviews, 42, 37-46.
14.Vento-Tormo, R., Efremova, M., Botting, R. A., Turco, M. Y., Vento-Tormo, M., Meyer, K. B., … & Teichmann, S. A. (2018). Single-cell reconstruction of the early maternal–fetal interface in humans. Nature, 563(7731), 347-353.
15.Papúchová, H., Meissner, T. B., Li, Q., Strominger, J. L., & Tilburgs, T. (2019). The dual role of HLA-C in tolerance and immunity at the maternal-fetal interface. Frontiers in immunology, 10, 2730.
16.Brenner, B., Hoffman, R., Blumenfeld, Z., Weiner, Z., & Younis, J. S. (2000). Gestational outcome in thrombophilic women with recurrent pregnancy loss treated by enoxaparin. Thrombosis and haemostasis, 83(05), 693-697.
17.Lash, G. E., Otun, H. A., Innes, B. A., Kirkley, M., De Oliveira, L., Searle, R. F., … & Bulmer, J. N. (2006). Interferon‐γ inhibits extravillous trophoblast cell invasion by a mechanism that involves both changes in apoptosis and protease levels. The FASEB journal, 20(14), 2512-2518.
18.Fu, B., Li, X., Sun, R., Tong, X., Ling, B., Tian, Z., & Wei, H. (2013). Natural killer cells promote immune tolerance by regulating inflammatory TH17 cells at the human maternal–fetal interface. Proceedings of the National Academy of Sciences, 110(3), E231-E240.
19.Fu, B., Li, X., Sun, R., Tong, X., Ling, B., Tian, Z., & Wei, H. (2013). Natural killer cells promote immune tolerance by regulating inflammatory TH17 cells at the human maternal–fetal interface. Proceedings of the National Academy of Sciences, 110(3), E231-E240.
20.Garrido-Gimenez, C., & Alijotas-Reig, J. (2015). Recurrent miscarriage: causes, evaluation and management. Postgraduate medical journal, 91(1073), 151-162.
21.Raghupathy, R. (2001, August). Pregnancy: success and failure within the Th1/Th2/Th3 paradigm. In Seminars in immunology (Vol. 13, No. 4, pp. 219-227). Academic Press.
22.Guo, W., Fang, L., Li, B., Xiao, X., Chen, S., Wang, J., … & Wang, X. (2017). Decreased human leukocyte antigen-G expression by miR-133a contributes to impairment of proinvasion and proangiogenesis functions of decidual NK cells. Frontiers in Immunology, 8, 741.
23.Coughlan, C., Ledger, W., Wang, Q., Liu, F., Demirol, A., Gurgan, T., … & Li, T. C. (2014). Recurrent implantation failure: definition and management. Reproductive biomedicine online, 28(1), 14-38.
24.Ramos‐Medina, R., García‐Segovia, A., Gil, J., Carbone, J., Aguaron de la Cruz, A., Seyfferth, A., … & Sánchez‐Ramón, S. (2014). Experience in ivi g therapy for selected women with recurrent reproductive failure and nk cell expansion. American Journal of Reproductive Immunology, 71(5), 458-466.
25.Ahmadi, M., Ghaebi, M., Abdolmohammadi‐Vahid, S., Abbaspour‐Aghdam, S., Hamdi, K., Abdollahi‐Fard, S., … & Yousefi, M. (2019). NK cell frequency and cytotoxicity in correlation to pregnancy outcome and response to IVIG therapy among women with recurrent pregnancy loss. Journal of cellular physiology, 234(6), 9428-9437.
26.Dakhly, D. M., Bayoumi, Y. A., Sharkawy, M., Allah, S. H. G., Hassan, M. A., Gouda, H. M., … & El-Khayat, W. (2016). Intralipid supplementation in women with recurrent spontaneous abortion and elevated levels of natural killer cells. International Journal of Gynecology & Obstetrics, 135(3), 324-327.
27.Von Woon, E., Day, A., Bracewell-Milnes, T., Male, V., & Johnson, M. (2020). Immunotherapy to improve pregnancy outcome in women with abnormal natural killer cell levels/activity and recurrent miscarriage or implantation failure: a systematic review and meta-analysis. Journal of Reproductive Immunology, 142, 103189.