Liệu pháp tế bào NK trong ung thư đường mật
Ung thư đường mật (cholangiocarcinoma, CCA) là bệnh lý khi các khối u ác tính, không đồng nhất xuất hiện tại một vị trí bất kì trên đường ống dẫn mật. Là một loại ung thư hiếm, chỉ chiếm khoảng 3% u ác tính đường tiêu hóa nhưng trong những năm gần đây, tỉ lệ mắc ung thư đường có xu hướng tăng nhanh ở các nước châu Âu và đặc biệt là ở Đông Á (1). Thái Lan là nước có tỉ lệ mắc ung thư đường mật cao nhất chuẩn hóa theo độ tuổi là 85/100.000 dân, tiếp theo là các nước châu Âu với tỉ lệ này từ 0,5-2/100.000 (1).
TẢI FILE PDF TẠI ĐÂY: Liệu pháp tế bào NK trong ung thư đường mật – PDF
Tại Mỹ, ước tính có 80000 ca mắc ung thư gan và mật trong 2022, trong đó, tỉ lệ mắc bệnh nam giới cao gấp đôi so với nữ giới (2). Tiên lượng đối với các bệnh nhân bị ung thư đường mật phụ thuộc vào giai đoạn và vị trí, tuy nhiên, ung thư đường mật thường được chẩn đoán ở giai đoạn muộn do các triệu chứng ban đầu thường khá mơ hồ và thường không có triệu chứng ở giai đoạn đầu dẫn đến khó khăn trong việc chẩn đoán (3). Theo đánh giá WHO, tỉ lệ tử vong do ung thư đường mật tại thế kỷ 21 có xu hướng tăng, đặc biệt ở nước châu Âu tỉ lệ tử vong tăng 36,5% ở nam giới và 36,2% ở nữ giới, tại Mỹ, tỉ lệ này ở nam và nữ lần lượt là 11,2% và 13,8% (4).
Việc điều trị ung thư đường mật phụ thuộc vào từng giai đoạn và vị trí giải phẫu của khối u, các phương pháp truyền thống như phẫu thuật, xạ trị và đặc biệt là hóa trị và ghép gan đang là những phương pháp điều trị phổ biến cho các bệnh nhân bị ung thư đường mật tuy nhiên thời gian sống không bệnh trung bình đối với bệnh nhân chỉ từ 12-36 tháng, tỉ lệ sống sót sau 5 năm dưới 10% (5). Hiện nay, các tiến bộ về di truyn và hiểu biết sinh học phân tử cho từng nhóm ung thư đường mật giúp cho việc điều trị đích và các thể hóa cũng như liệu pháp miễn dịch được ứng dụng để điều trị cho bệnh nhân và đang được thử nghiệm lâm sàng mang lại tín hiệu khả quan. Trong đó, Liệu pháp tế bào giết tự nhiên (Natural Killer Cell) NK được xem là một hướng điều trị mới cho các bệnh nhân mắc ung thư đường mật.
Ung thư đường mật và tế bào NK trong ung thư đường mật
Đường mật là hệ thống đường ống có chức năng dẫn mật được sản xuất từ gan xuống tá tràng để tiêu hóa thức ăn. Đường ống dẫn mật có thể chia làm ba vùng tùy vào vị trí giải phẫu của chúng đó là ống dẫn mật trong gan, ống dẫn mật ngoài gan và tuyến mật. Các ống mật trong gan bắt nguồn từ kênh Hering tại gan dưới dạng các ống nhỏ (<15μm) hoặc ống lớn (>15μm). Đường mật ngoài gan là các ống dẫn mật phải và trái và kết thúc là đường dẫn mật vào tá tràng (6). Ung thư đường mật cũng được phân chia thành 3 dạng dựa vào vị trí giải phẫu của chúng bao gồm: Ung thư đường mật trong gan (iCCA), ung thư đường mật ngay bên ngoài gan (pCCA) là vị trí ống mật thoát ra bên ngoài gan và ung thư đường mật xa gan (dCCA) là vị trí nơi ống mật gần đi vào ống tiêu hóa (ruột, tá tràng) (6,7).
Trong các dạng ung thư đường mật, số ca mắc pCCA chiếm 50-60%, dCCA chiếm 20-30% và iCCA chiếm 10%. iCCA cũng là loại ung thư gan nguyên phát phổ biến thứ hai ở gan sau ung thư biểu mô tế bào gan (1). Triệu chứng biểu hiện ung thư đường mật thường không rõ ràng ở giai đoạn đầu, khi khối u phát triển dẫn đến mật không thể tiết ra ngoài gan có thể dẫn đến viêm gan, chướng bụng, vàng da, vàng mắt, giảm cân và một vài triệu chứng khác. Các bệnh nhân có các yếu tố nguy cơ như mắc viêm đường mật xơ cứng nguyên phát (PSC), viêm gan B, viêm gan C cần sàng lọc ung thư đường mật do có tỉ lệ mắc cao hơn, tuy nhiên, 50% số ca mắc ở châu Âu thường không có yếu tố nguy cơ cụ thể nào (1,8).
Các phương pháp điều trị ung thư đường mật thường phụ thuộc vào vị trí, giai đoạn của bệnh. Phẫu thuật là lựa chọn điều trị phổ biến cho cả ba dạng ở các bệnh nhân tại giai đoạn đầu. Các bệnh nhân pCCA thường được hóa trị liệu và ghép gan sau đó, ngược lại, iCCA lại chống chỉ định cho việc ghép gan. Đối với các trường hợp bệnh nhân giai đoạn tiến triển hoặc không thể cắt bỏ các biện pháp điều trị như hóa trị theo tiêu chuẩn (gemcitabine và cisplatin) thường có thời gian sống dưới 1 năm (4,9). Trong các hướng điều trị mới cho các bệnh nhân bị ung thư đường mật, liệu pháp miễn dịch đang được nghiên cứu và áp dụng mạnh mẽ, trong đó, tế bào NK được xem là đối tượng nghiên cứu rất tiềm năng do vai trò của nó trong việc tiêu diệt các tế bào ung thư và điều hòa miễn dịch. Đặc biệt, gan là một trong những cơ quan tập trung lượng lớn tế bào NK (10).
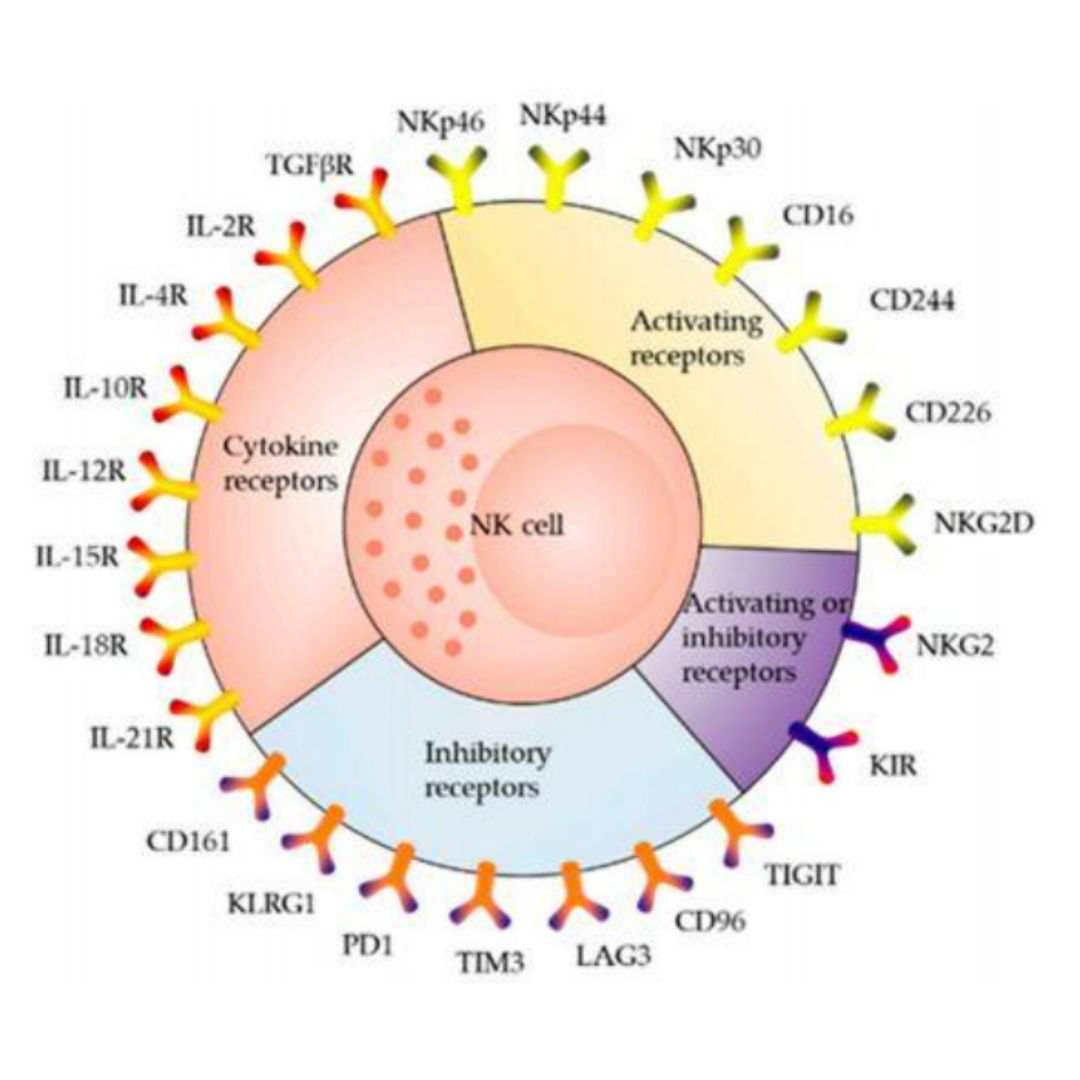
Tế bào NK là một tế bào bạch huyết, cùng với các tế bào khác như tế bào đuôi gai, bạch cầu đơn nhân và đại thực bào tạo thành hệ miễn dịch bẩm sinh ở người (11). Được hình thành từ các tế bào gốc tạo máu trong tủy xương, các tế bào NK tồn tại trong máu và một số các cơ quan như gan, tử cung và lá lách. Đặc trưng phân biệt của tế bào bào NK và các tế bào khác là không có sự biểu hiện của các thụ thể tế bào T (TCR) và chỉ thị CD3 trên bề mặt nhưng có sự biểu hiện của chỉ thị CD56. Quần thể tế bào NK được chia hai loại là CD56dim and CD56bright (12). Hoạt động của tế bào NK được điều hoà bằng các thụ thể kích hoạt và ức chế tồn tại trên bề mặt (hình 1).
Các tín hiệu thu được từ các thụ thể này khi chúng tương tác với các phối tử tương ứng trên các tế bào đích giúp cho tế bào NK quyết định có gây độc và tiêu diệt nó hay không hoặc điều chỉnh tăng hoặc giảm bài biết cytokine. Các phối tử thường là các phân tử MHC-I có mặt trên tất cả các loại tế bào của cơ thể. Ở các tế bào ung thư, các phân tử MHC-I thường có biểu hiện mất cân bằng, đây là nguyên nhân gây ra các tín hiệu từ các thụ thể ức chế/kích hoạt của tế bào NK bị thay đổi cho phép tế bào NK gây độc các tế bào này (13).
Hình 1: Các thụ thể trên tế bào NK (ức chế, kích hoạt, cảm ứng cytokine)
Tế bào NK chiếm 30-40% lượng tế bào NK tại gan (liver NK, Lr-NK). Khác với máu ngoại vi, tỉ lệ tế bào lr-NK CD56dim and CD56bright là như nhau ở gan. Kiểu hình cụ thể cụ thể lr-NK biểu hiện các thụ thể chomkine CXR6 và CCR5 cùng với các chỉ thị khu trú mô CD68, sự biểu hiện nhiều thụ thể này có thể liên quan đến việc các phối tử của chúng như CL3, CCL5 và CXCL16 xuất hiện nhiều trên các tế bào đường mật, tế bào nội mô hình sin và tế bào gan, điều này giúp duy trì cân bằng miễn dịch của tế bào NK bên trong gan (14). Các tế bào Lr-NK có khả năng gây gộc tế bào mạnh, biểu hiện cao các phối tử TRAIL và Fasl kích thích quá trình chết theo chu trình, tiết ra IFN-γ, TNF-a, yếu tố kích thích đại thực bào GM-CSF (15).
Các tế bào khối u iCCA có thể gây suy giảm giám sát miễn dịch của tế bào NK thông qua việc gây ra quá trình chết theo chu trình của tê bào NK (14). Ở các bệnh nhân bị viêm đường mật xơ cứng nguyên phát (PSC) có nguy cơ rất cao bị ung thư đường mât, nghiên cứu của Melun và cộng sự năm 2008 cho thấy trên 365 bệnh nhân PSC, trong đó 49 bệnh nhân tiến triển CCA cho thấy có sự đa hình nucleotide (SNP) ở gen mã hóa cho thụ thể kích thích NKG2D trên tế bào NK ở các bệnh nhân này so với nhóm còn lại, điều này làm thấy, việc tế bào NK bị suy giảm miễn dịch với thụ thể NKG2D làm tăng khả năng bị CCA (15).
Các thụ thể giết tự nhiên giống giống globulin miễn dịch (KIR) nằm trên tê bào NK cũng đóng vai trò quan trọng cho hoạt động gây độc của tế bào NK khi có khả năng nhận diện các sự tăng giảm biểu hiện của phối tử là các HLA-I trên các tế bào ung thư từ đó giúp tế bào NK gây độc tiêu diệt các tế bào này (12). Nghiên cứu của Cornillet năm 2019 trên 148 bệnh nhân CCA ở Thụy Điển về các gen mã hóa KIR, kết quả thể hiện các bệnh nhân CCA có nhiều thay đổi tại locus gen KIR, đặc biệt là biểu hiện thấp của gen mã hóa thụ thể KIR2DL3 trên các bệnh nhân CCA so với nhóm khỏe mạnh (16). Sự biểu hiện tăng cao trong khối u của CXCL9, một chemokine cảm ứng IFN-γ, có liên quan đến khả năng xâm nhập khối u của các tế bào NK dẫn đến tăng khả năng sống sót thuận lợi sau phẫu thuật cho các bệnh nhân bị iCCA liên quan đến một số lượng lớn tế bào NK xâm nhập khối u, dẫn đến khả năng sống sót thuận lợi sau phẫu thuật ở bệnh nhân mắc iCCA (17).
Liệu pháp tế bào NK cho ung thư đường mật
Liệp pháp miễn dịch, cụ thể là liệu pháp tế bào NK cho điều trị ung thư đường mật đã và đang được nghiên cứu cho thấy kết quả đáng ghi nhận. Nghiên cứu thử nghiệm hoạt tính tế bào NK đối với tế bào ung thư CCA được thử nghiệm trong điều kiện invito đã được thực hiện bởi nhóm nghiên cứu Jung (2019), dòng tế bào HuCCT-1 ở người là dòng tế bào ung thư iCCA được cấy ghép và chuột.
Chuột mang khối u được truyền nhiều lần tế bào NK (SMT01) từ người khỏe mạnh được tăng sinh và kích hoạt với IL-2 với liều 4×104 tế bào/con. Kết quả cho thấy các khối u CC bị ức chế phát triển đáng kể và trọng lượng chuột thuộc nhóm chuột truyền tế bào NK được duy trì ổn định so với nhóm chuột thực hiện điều trị hóa trị. Kết quả này chứng minh cho các tế bào NK có hoạt tính chống ung thư CCA và cải thiện chất lượng cuộc sống (18). Một đánh giá invito khác cũng thử nghiệm hoạt tính tế bào NK-92 kết hợp Cordycepin, một chất được tách chiết từ đông trùng hạ thảo.
Tế bào NK-92 khi được nuôi cấy có bổ sung cordycepin cho thấy khả năng tiêu diệt dòng tế bào ung thư CCA KKU-213A tốt hơn so với dùng NK-92 đơn độc. Nguyên nhân có thể do cordycepin tăng sự biểu hiện thụ thể TRAIL (DR4 và DR5) trong KKU-213A )(19). Thử nghiệm lâm sàng giai đoạn 1 đa trung tâm được thực hiện tại Hàn Quốc, sử dụng dòng tế bào NK đồng loài có hoạt tính cao (SMT-NK) kết hợp pembrolizumab ở những bệnh nhân CCA tiến triển và kháng trị với cisplatin/gemcitabine, 40 bệnh nhân tham gia (>19 tuổi) mắc CCA được truyền tế bào SMT-NK liều 3×106 tế bào/kg lần 1 và 2 cách nhau 7 ngày, pembrolizumab 200mg được sử dụng trước khi truyền lần 1.
Một chu kì điều trị là 3 tuần. Kết quả thử nghiệm cho thấy không xuất hiện các tác dụng phụ không chịu đựng nghiêm trong nào trên các bệnh nhân, chỉ tiêu đáp ứng hoàn toàn (Objective response rate –ORR) cho thấy mức độ thuyên giảm của bệnh nhân là 17,4%. Một số bệnh nhân có đáp ứng tốt nhất giảm tới 82,3% các hạch bạch huyết di căn hoặc giảm 70,4% các tổn thương di căn gan và không bị tiến triển sau 12 tháng kể từ lần điều trị ban đầu (20). Một thử nghiệm lâm sàng khác cũng được thực hiện tại Trung Quốc, kết hợp giữa xạ trị và truyền tế bào NK đồng loài cho các bệnh nhân CCA, tuy nhiên, kết quả đánh giá thử nghiệm này chưa được công bố (21).
Liệu pháp tế bào NK đã và đang được nghiên cứu, đánh giá trong điều trị ung thư đường mật và các loại ung thư khác. Với tiến bộ trong y học chính xác dựa trên kết quả của lĩnh vực chẩn đoán di truyền và tế bào miễn dịch giúp cho phương pháp này thực sự hứa hẹn, hơn nữa, việc kết hợp các phương pháp truyền thống và liệp pháp tế bào miễn dịch cũng đem lại kết quả khả quan giúp cải thiện thời gian và chất lượng sống cho người bệnh. Tuy còn chưa có nhiều đánh giá lâm sàng và đánh giái độ an toàn, liệu pháp NK cho ung thư đường mật vẫn là phương pháp điều trị tiềm năng và có triển vọng.
Tài liệu tham khảo:
1. Khan, S. A., Tavolari, S., & Brandi, G. (2019). Cholangiocarcinoma: Epidemiology and risk factors. Liver International, 39, 19-31.
2. Siegel, R. L., Miller, K. D., Fuchs, H. E., & Jemal, A. (2022). Cancer statistics, 2022. CA: a cancer journal for clinicians, 72(1), 7-33.
3. Izquierdo-Sanchez, L., Lamarca, A., La Casta, A., Buettner, S., Utpatel, K., Klümpen, H. J., … & Banales, J. M. (2022). Cholangiocarcinoma landscape in Europe: Diagnostic, prognostic and therapeutic insights from the ENSCCA Registry. Journal of hepatology, 76(5), 1109-1121.
4. Rizvi, S., Khan, S. A., Hallemeier, C. L., Kelley, R. K., & Gores, G. J. (2018). Cholangiocarcinoma—evolving concepts and therapeutic strategies. Nature reviews Clinical oncology, 15(2), 95-111.
5. Polidoro, M. A., Mikulak, J., Cazzetta, V., Lleo, A., Mavilio, D., Torzilli, G., & Donadon, M. (2020). Tumor microenvironment in primary liver tumors: a challenging role of natural killer cells. World journal of gastroenterology, 26(33), 4900.
6. Ray, D., Han, Y., Maroni, L., Marzioni, M., Meng, F., Alpini, G., & Glaser, S. (2015). Liver Regeneration: The Biliary Perspective. In Liver Regeneration (pp. 229-241). Academic Press.
7. Lim, J. H. (2003). Cholangiocarcinoma: morphologic classification according to growth pattern and imaging findings. AJR. American journal of roentgenology, 181(3), 819-827.
8. Plentz, R. R., & Malek, N. P. (2015). Clinical presentation, risk factors and staging systems of cholangiocarcinoma. Best practice & research Clinical gastroenterology, 29(2), 245-252.
9. Valle, J., Wasan, H., Palmer, D. H., Cunningham, D., Anthoney, A., Maraveyas, A., … & Bridgewater, J. (2010). Cisplatin plus gemcitabine versus gemcitabine for biliary tract cancer. New England Journal of Medicine, 362(14), 1273-1281.
10. Polidoro, M. A., Mikulak, J., Cazzetta, V., Lleo, A., Mavilio, D., Torzilli, G., & Donadon, M. (2020). Tumor microenvironment in primary liver tumors: a challenging role of natural killer cells. World journal of gastroenterology, 26(33), 4900.
11. Vivier, E., Raulet, D. H., Moretta, A., Caligiuri, M. A., Zitvogel, L., Lanier, L. L., … & Ugolini, S. (2011). Innate or adaptive immunity? The example of natural killer cells. science, 331(6013), 44-49
12. Vivier, E., Tomasello, E., Baratin, M., Walzer, T., & Ugolini, S. (2008). Functions of natural killer cells. Nature immunology, 9(5), 503-510.
13. Miller, J. S., & Lanier, L. L. (2019). Natural killer cells in cancer immunotherapy. Annual review of cancer biology, 3, 77-103.
14. Hayashi, T., Imai, K., Morishita, Y., Hayashi, I., Kusunoki, Y., & Nakachi, K. (2006). Identification of the NKG2D haplotypes associated with natural cytotoxic activity of peripheral blood lymphocytes and cancer immunosurveillance. Cancer research, 66(1), 563-570.
15. Melum, E., Karlsen, T. H., Schrumpf, E., Bergquist, A., Thorsby, E., Boberg, K. M., & Lie, B. A. (2008). Cholangiocarcinoma in primary sclerosing cholangitis is associated with NKG2D polymorphisms. Hepatology, 47(1), 90-96.
16. Cornillet, M., Jansson, H., Schaffer, M., Hertwig, L., Berglin, L., Zimmer, C. L., … & Björkström, N. K. (2019). Imbalance of genes encoding natural killer immunoglobulin-like receptors and human leukocyte antigen in patients with biliary cancer. Gastroenterology, 157(4), 1067-1080.
17. Fukuda, Y., Asaoka, T., Eguchi, H., Yokota, Y., Kubo, M., Kinoshita, M., … & Doki, Y. (2020). Endogenous CXCL9 affects prognosis by regulating tumor‐infiltrating natural killer cells in intrahepatic cholangiocarcinoma. Cancer science, 111(2), 323-333.
18. Jung, I. H., DO HEE, K. I. M., DA KYUNG, Y. O. O., Baek, S. Y., Jeong, S. H., Jung, D. E., … & Chung, Y. Y. (2018). In vivo study of natural killer (NK) cell cytotoxicity against cholangiocarcinoma in a nude mouse model. in vivo, 32(4), 771-781.
19. Panwong, S., Wathikthinnakon, M., Kaewkod, T., Sawasdee, N., Tragoolpua, Y., Yenchitsomanus, P. T., & Panya, A. (2021). Cordycepin sensitizes cholangiocarcinoma cells to be killed by natural killer-92 (NK-92) cells. Molecules, 26(19), 5973.
20. Leem, G., Jang, S. I., Cho, J. H., Jo, J. H., Lee, H. S., Chung, M. J., … & Park, S. W. (2022). Safety and Efficacy of Allogeneic Natural Killer Cells in Combination with Pembrolizumab in Patients with Chemotherapy-Refractory Biliary Tract Cancer: A Multicenter Open-Label Phase 1/2a Trial. Cancers, 14(17), 4229.
21. Loeuillard, E., Conboy, C. B., Gores, G. J., & Rizvi, S. (2019). Immunobiology of cholangiocarcinoma. JHEP Reports, 1(4), 297-311.