Liệu pháp tế bào NK tự thân và từ máu cuống rốn, ưu điểm và nhược điểm
Hiện nay, ung thư đang là mối đe dọa nghiêm trọng tới sức khỏe con người và là nguyên nhân gây ra tử vong hàng đầu trên thế giới. Theo thống kê mỗi năm chúng ta có khoảng 10 triệu ca tử vong vì ung thư và hơn 19 triệu ca được chẩn đoán ung thư trong năm 2020. Ung thư vú là loại ung thư có tỉ lệ cao nhất chiếm 11,7% số ca mắc ở nữ giới, còn ở nam giới, ung thư phổi đứng đầu với 14,3% (1). Ung thư phổi và ung thư vú cũng lần lượt là loại ung thư có tỉ lệ gây tử vong cao nhất ở nam và nữ với 21,5% và 15,5% số ca tử vong. Bên cạnh việc phát hiện sớm và phòng ngừa ung thư, các phương pháp điều trị ung thư mới là một hướng đi giúp nâng cao hiệu quả điều trị và nâng cao chất lượng sống cho các bệnh nhân bị ung thư.
Các phương pháp điều trị truyền thống như phẫu thuật, hóa trị, xạ trị đã và đang được sử dụng điều trị cho các loại bệnh ung thư. Tuy nhiên, các phương pháp điều trị này lại có rất nhiều tác dụng phụ như viêm niêm mạc miệng, nhiễm độc gan thận, suy giảm hệ tạo máu và giảm chất lượng sống của bệnh nhân dẫn đến việc ngừng điều trị (2). Cùng với sự tiến bộ của các nghiên cứu chuyên sâu về hệ miễn dịch, các tế bào miễn dịch chứng minh được vai trò quan trọng của nó đối với việc điều trị và phòng chống ung thư và liệu pháp miễn dịch trở thành phương pháp thứ tư được áp dụng để điều trị ung thư.
Các liệu pháp miễn dịch tế bào được phát triển trên các dòng tề bào miễn dịch như tế bào lympho T, lympho B và tế bào giết tự nhiên (Natural killer cell, NK) dựa vào vai trò của chúng trong hệ miễn dịch ung thư (3). Liệu pháp tế bào NK là một trong liệu pháp tế bào miễn dịch mới nhất đang được nghiên cứu và cho tiềm năng rất lớn cho liệu pháp tế bào miễn dịch trong điều trị ung thư. Tế bào NK có thể được thu nhận từ máu cuống rốn hoặc nguồn tự thân.
TẢI FILE PDF TẠI ĐÂY: Ưu và nhược điểm liệu pháp tế bào NK tự thân và từ máu cuống rốn – PDF
Tế bào NK và các liệu pháp tế bào miễn dịch dựa trên tế bào NK
Tế bào NK là một tế bào bạch huyết, cùng với các tế bào khác như tế bào đuôi gai, bạch cầu đơn nhân và đại thực bào tạo thành hệ miễn dịch bẩm sinh ở người (4). Được hình thành từ các tế bào gốc tạo máu trong tủy xương, các tế bào NK tồn tại trong máu và một số các cơ quan như gan, tử cung và lá lách. Đặc trưng phân biệt của tế bào bào NK và các tế bào khác là không có sự biểu hiện của các thụ thể tế bào T (TCR) và có sự biểu hiện của chỉ thị CD56. Quần thể tế bào NK được chia hai loại là CD56dim and CD56bright (5). Hoạt động của tế bào NK được điều hoà bằng các thụ thể kích hoạt và ức chế tồn tại trên bề mặt.
Các tín hiệu thu được từ các thụ thể này khi chúng tương tác với các phối tử tương ứng trên các tế bào đích giúp cho tế bào NK quyết định có gây độc và tiêu diệt nó hay không hoặc điều chỉnh tăng hoặc giảm bài biết cytokine. Các phối tử thường là các phân tử MHC-I có mặt trên tất cả các loại tế bào của cơ thể. Ở các tế bào ung thư, các phân tử MHC-I thường có biểu hiện mất cân bằng, đây là nguyên nhân gây ra các tín hiệu từ các thụ thể ức chế/kích hoạt của tế bào NK bị thay đổi cho phép tế bào NK gây độc các tế bào này (6).
Khả năng gây độc tế bào NK được thể hiện qua tiết các perforin các protein gây độc, chúng chèn vào màng sinh chất của tế bào đích và hình thành các lỗ dẫn đến việc mất thẩm thấu của tế bào và granzyme có khả năng khích hoạt caspase gây ra việc chết theo chu trình (7). Tế bào NK còn có thể tiêu diệt trực tiếp tế bào đích thông qua sự biểu hiện của phối tử FAS và phối tử gây quá trình chết theo chu trình TNF (TRAIL) (6). Ngoài ra, tế bào NK có thể tiết ra hàng loạt các cytokine và chemokine như IFN-γ, IL-10, CCL3, CCL4 có vai trò quan trọng trong việc thúc đẩy hoạt động của các tế bào Lympho B và Lympho T tiêu diệt các tế bào ung thư (5).
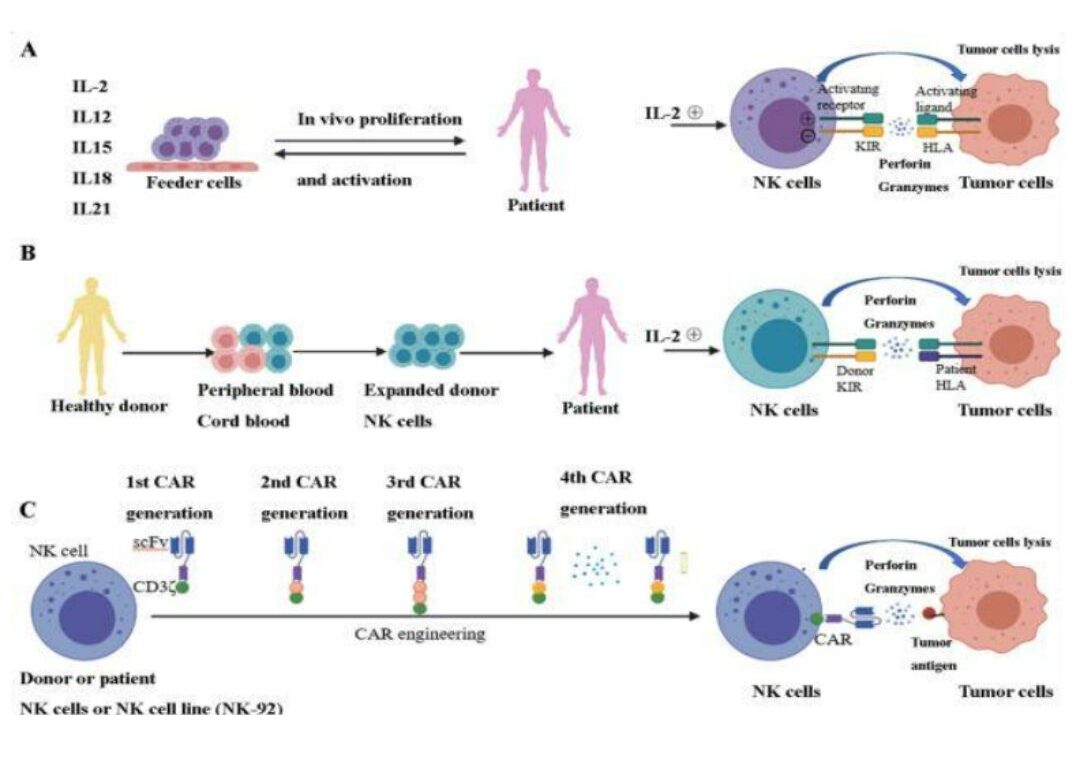
Các đặc điểm sinh học kể trên của tế bào NK cho phép chúng nhận biết các tế bào ngay bên cạnh chúng có dấu hiệu bị ung thư hay không và tiêu diệt chúng. Đặc biệt, việc không có thụ thể TCR trên bề mặt làm cho tế bào NK không gây ra hiện tượng thải gép vật chủ (GVHD). Các đặc điểm duy nhất này trên tế bào NK cùng với các phương pháp giúp nuôi cấy in vitro giúp gia tăng lượng lớn tế bào NK từ các nguồn khác nhau như tự thân hoặc đồng loài đã tạo ra liệu pháp tế bào NK trong điều trị ung thư (Hình 1). Trong đó, nguồn tế bào NK tự thân chủ yếu đến từ máu ngoại vi (PB-NK), ngược lại, nguồn tế bào NK đồng loài có thể từ nguồn máu cuống rốn (CB-NK), các dòng NK đặc biệt, tế bào gốc vạn năng iPSC và Car-NK (8).
Hình 1. Liệu pháp tế bào NK: A- Nguồn NK tự thân bệnh nhân, B- Nguồn đồng loại từ người hiến khỏe mạnh, C- nguồn NK thương mại, Car-NK
Điểm khác biệt giữa liệu pháp NK từ máu tự thân và NK từ máu cuống rốn
Về bản chất, liệu pháp sử dụng tế bào NK để điều trị là quá trình phân lập, nuôi cấy tăng sinh và kích thích các tế bào NK trước khi truyền vào cơ thể người bệnh (9). Đối Liệu pháp tế bào NK tự thân, nguồn tế bào NK chủ yếu được phân lập từ máu ngoại vi, tủy xương của chính người bệnh. Ngược lại CB-NK được phân lập từ máu cuống rốn: là lượng máu thu được từ phần còn lại trên dây rốn và bánh nhau sau khi em bé ra đời, được đông lạnh và lưu trữ trong các ngân hàng sinh học. Trong máu ngoại vi, tế bào PB-NK chiếm khoảng 10-15% tổng số tế bào lympho, 90% các tế bào này là các tế bào CD56dimCD16+, các tế bào còn được gọi là các tế bào Nk trưởng thành, có khả năng gây độc tế bào rất cao do đã biểu hiện đầy đủ các thụ thể kích hoạt trên bề mặt và có khả năng tiết ra perforin và granzyme, phần còn lại chỉ 10% là các tế bào NK CD56bright có khả năng tiết Cytokine (5).
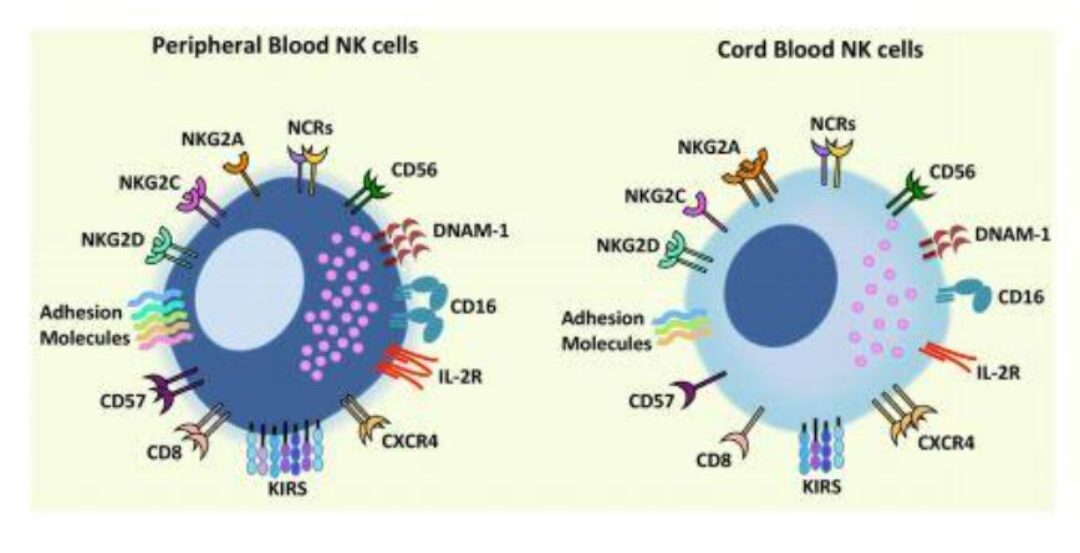
Với Liệu pháp NK từ máu cuống rốn, tế bào NK chiếm 25-30% tổng số tế bào Lympho, cao hơn so với NK từ máu ngoại vi. Tỉ lệ quần thể CD56dimCD16+ và CD56bright không có sự khác nhau nhiều so với máu ngoại vi (10). Tuy nhiên, trong máu cuống rốn, còn có các quần thể tế bào NK khác được phân biệt dựa trên chỉ thị CD16, CD94 và CD117, các quần thể này được gọi là tế bào NK tiền trưởng thành, có mức độ gây độc thấp hơn so với PB-NK (11). Theo nghiên cứu của Luevano và cộng sự đã so sánh khả năng tiết perforin, granzyme và biểu hiện các phối tử bề mặt FAS-L và TRAIL đặc trưng cho khả năng gây độc trực tiếp của tế bào PB-NK và các tế bào CB-NK. Hai loại tế bào này được nuôi cấy trong môi trường bổ sung IL-2 giúp tăng sinh và kích hoạt tế bào NK. Kết quả cho thấy, qua 7 ngày nuôi cấy, các quần thể tế bào CB-CD56dim-NK biểu hiện perforin, granzyme và FAS-L thấp hơn khoảng 30-40% so với PB-CD56dim-NK. Quần thể CD56bright-NK ở cả máu cuống rốn và máu ngoại vi đều có mức biểu hiện như nhau (12). Việc giảm biểu hiện khả năng gây độc của CB-NK có thể do việc biểu hiện ít các thụ thể kích thích KIRs, NKG2C, NKp46 và DNAM-1 so với PB-NK (Hình 2). Ngược lại, có sự biểu hiện CB-NK có sự biểu hiện thụ thể ức chế NKG2A cao hơn so với PB-NK (12,13).
Hình 2. Các thụ thể kích thích và ức chế trên tế bào PB-NK và UC-NK
Liệu pháp tế bào NK yêu cầu sử dụng một lượng lớn tế bào NK để tiến hành điều trị. Trong quá trình nuôi cấy, để tăng tốc độ tăng sinh NK và kích hoạt các tế bào này vào giai đoạn trưởng thành có khả năng gây độc cao, các cytokine và các dòng tế bào nuôi (Feeder cell) được bổ sung. Các cytokine thường được sử dụng nhiều nhất đó là IL-2, ngoài ra còn có IL-12, IL15, IL-18 hoặc IL-21 và IFN Loại I, các cytokine tương tác với các thụ thể của chúng trên tế bào NK, kích thích tế bào NK phân chia và biểu hiện các thụ thể kích thích (14). Các tế bào UC-NK đáp ứng kích hoạt cần nồng độ IL-2 cao hơn gấp 5 lần so với các tế bào PB-NK (14). Nguyên nhân ban đầu có thể do việc tế bào UC-NK biểu hiện ít các thụ thể IL-2 và giảm quá trình phosphoryl hóa STAT5 so với các tế bào NK, hơn nữa, sau khi kích hoạt bằng IL-2, tỉ lệ biểu hiện các thụ thể kích hoạt như NKp44, CD69 của PB-NK cao hơn so với UC-NK, điều này cho thấy khả năng gây độc của PB-NK cao hơn UC-NK khi được kích hoạt bởi IL-2 (12). Theo nghiên cứu Alnabhan và cộng sự cho thấy các tế bào UC-NK và PB-NK đều được kích hoạt bằng các IL-15 và IL-18, tuy nhiên, tế bào UC-NK được kích hoạt nhiều hơn khi đáp ứng với IL-15 hơn là IL-2, tế bào khi được kích hoạt bởi IL-15, IL-18 cho thấy khả năng gây độc tốt hơn và tăng sản xuất các cytokine như IFN-g vai trò chống khối u (15).
Ưu và nhược điểm của liệu pháp NK tự thân
Cho đến gầy đây, 92% các nghiên cứu lâm sàng về sử dụng tế bào NK có nguồn gốc từ máu ngoại vi, trong đó, liệu pháp tế bào NK tự thân chiếm 13%, điều này dẫn đến các đánh giá về tình an toàn và hiệu quả điều trị của liệu pháp NK từ nguồn máu ngoại vi hay tự thân là đáng tin cậy (16). Về nguồn tế bào NK, ưu điểm của liệu pháp NK tự thân đó là dễ huy động, có tới 90% lượng tế bào NK trưởng thành trong quần thể PB-NK, có khả năng gây độc cao (5). Hơn nữa, nguồn gốc tự thân nên không gây ra hiệu ứng thải mảnh ghép khi truyền, do việc có lẫn một phần tế bào lympho T khi nuôi cấy. So với nguồn đồng loại, NK tự thân không phải thực hiện xét nghiệm đánh giá độ an toàn sản phẩm truyền như xét nghiệm virus, mycoplasma và không phải chi trả chi phí cho việc mua các đơn vị máu cuống rốn, dòng tế bào NK thương mai giúp giảm bớt chi phí. Quan trọng hơn, đó chính là vấn đề PB-NK tự thân đáp ứng hoàn toàn vấn đề về pháp lý và độ an toàn khi sử dụng hơn là các dòng NK từ người hiến tặng, máu cuống rốn và dòng tế bào NK thương mại (17). Khả năng nuôi cấy tăng sinh của tế bào PB-NK hiệu quả hơn so với các dòng tế bào NK khác, PB-NK có khả năng đáp ứng tốt với IL-2 tốt hơn dòng UC-NK ở nồng độ thấp, khả năng gây độc của PB-NK cũng cao hơn khi được kích hoạt bằng IL-2 (18,12).
Việc tế bào NK chỉ chiếm 10% tổng số tế bào lympho trong máu ngoại vi dẫn đến số lượng tế bào NK huy động được ít hơn so với các dòng NK thương mại, hơn nữa, độ đồng nhất của PB-NK thấp hơn do có chứa nhiều loại tế bào khác (18). Hơn nữa, đối với các bệnh nhân ung thư, việc huy động máu ngoại vi để phân lập NK thường tốn nhiều thời gian và phải trải qua điều trị hoặc thủ thuật trong khi các việc sử dụng các nguồn tế bào NK khác như UC-NK, đồng loại thì có sẵn (17,10). Ở các bệnh nhân bị ung thư, việc sử dụng chính tế bào NK để điều trị có thể dẫn đến khả năng NK hoạt động mức tối thiểu, điều này có thể giải thích do ức chế tiêu diệt tế bào ung thư dựa trên nhận biết phức hợp MHC-I trên tế bào khối u bị giảm do chất ức chế KIR (19). Nghiên cứu Rosenberg và cộng sự sử dụng PB-NK tự thân, đã kích hoạt IL-2 để điều trị cho 8 bệnh nhân bị ung thư cầu thận với liều dùng 4,7×1010 tế bào NK/kg cân nặng, kết quả cho thấy tế bào NK tồn tại khá lâu trong cơ thể bệnh nhân từ vài tuần đến vài tháng.
Tuy nhiên, các tế bào NK này lại không biểu hiện đáng kể thụ thể kích thích NKG2D trên bề mặt và không có khả năng thể ly giải tế bào ung thư trong điều kiện ống nghiệm nếu không kích thích lại bằng IL-2 (20). Ngoài ra, một giới hạn nữa cho việc sử dụng NK tự thân đó là các tế bào NK tự thân dễ bị tổn thương và khó nhận biết đối với các tế bào ung thư đã kháng trị, điều này ảnh hưởng rất nhiều đến việc sử dụng NK tự thân cho liệu pháp miễn dịch ung thư (21). Hoạt động chức năng của các tế bào NK tự thân bị hạn chế ở bệnh nhân ung thư, chủ yếu là do sự phù hợp phối tử KIR (22). Khả năng tương thích của các tế bào NK được thúc đẩy bởi sự không phù hợp giữa các thụ thể KIR và các phối tử của chúng biểu hiện trên bề mặt tế bào khối u đích trong cấy ghép tế bào gốc tạo máu (HSCT) đã được chứng minh là tạo ra hoạt động chống khối u mạnh và hạn chế bệnh mảnh ghép chống lại vật chủ (GvHD) (23).
Nghiên cứu Ruggeri và cộng sự đã thực hiện sử việc ghép tế bào tạo máu cho các bệnh nhân bị ung thư máu Leukemia kinh dòng bạch cầu hạt (myeloid leukemia) dựa trên không phù hợp về KIR trên tế bào NK giữa người cho và nhận, kết quả ghép trên 51 bệnh nhân cho thấy tỉ lệ bị tái phát rất thấp chỉ 3%, tỷ lệ bệnh nhân trong tình trạng nặng có sự đáp ứng thuyên giảm hoàn toàn lên tới 67%.
Mặc dù việc sử dụng tế bào NK tự thân trong điều trị ung thư còn đang được nghiên cứu và đánh giá và có kết quả đáng ghi nhận. Liệu pháp NK tự thân vẫn khá an toàn và được ứng dụng mạnh mẽ trong việc dự phòng ung thư và giảm tái phát (9). Bên cạnh đó, các liệu pháp NK từ nguồn đồng loại khác như: Người hiến tặng khỏe mạnh, dòng tế bào NK thương mại, Máu cuống rốn và tế bào gốc vạn năng iPSC cũng đang được đánh giá và thử nghiệm lâm sàng. Các kết quả và thử nghiệm lâm sàng trên giúp cho việc sử dụng tế bào NK cho điều trị và dự phòng ung thư trở nên đáng tin cậy và có thể trở thành xu hướng điều trị mới, hiệu quả hơn so với các phương pháp điều trị truyền thống khác.
Tài liệu tham khảo
1. Chhikara, B. S., & Parang, K. (2023). Global Cancer Statistics 2022: the trends projection analysis. Chemical Biology Letters, 10(1), 451-451.
2. Zhang, Q. Y., Wang, F. X., Jia, K. K., & Kong, L. D. (2018). Natural product interventions for chemotherapy and radiotherapy-induced side effects. Frontiers in pharmacology, 9, 1253.
3. Weber, E. W., Maus, M. V., & Mackall, C. L. (2020). The emerging landscape of immune cell therapies. Cell, 181(1), 46-62.
4. Vivier, E., Raulet, D. H., Moretta, A., Caligiuri, M. A., Zitvogel, L., Lanier, L. L., … & Ugolini, S. (2011). Innate or adaptive immunity? The example of natural killer cells. science, 331(6013), 44-49
5. Vivier, E., Tomasello, E., Baratin, M., Walzer, T., & Ugolini, S. (2008). Functions of natural killer cells. Nature immunology, 9(5), 503-510.
6. Miller, J. S., & Lanier, L. L. (2019). Natural killer cells in cancer immunotherapy. Annual review of cancer biology, 3, 77-103.
7. Voskoboinik, I., Whisstock, J. C., & Trapani, J. A. (2015). Perforin and granzymes: function, dysfunction and human pathology. Nature Reviews Immunology, 15(6), 388-400.
8. Shimasaki, N., Jain, A., & Campana, D. (2020). NK cells for cancer immunotherapy. Nature reviews Drug discovery, 19(3), 200-218.
9. Terunuma, H., Deng, X., Nishino, N., & Watanabe, K. (2013). NK cell-based autologous immune enhancement therapy (AIET) for cancer. Journal of stem cells & regenerative medicine, 9(1),
10. Dalle, J. H., Menezes, J., Wagner, É., Blagdon, M., Champagne, J., Champagne, M. A., & Duval, M. (2005). Characterization of cord blood natural killer cells: implications for transplantation and neonatal infections. Pediatric research, 57(5), 649-655.
11. Farag, S. S., & Caligiuri, M. A. (2006). Human natural killer cell development and biology. Blood reviews, 20(3), 123-137.
12. Luevano, M., Daryouzeh, M., Alnabhan, R., Querol, S., Khakoo, S., Madrigal, A., & Saudemont, A. (2012). The unique profile of cord blood natural killer cells balances incomplete maturation and effective killing function upon activation. Human immunology, 73(3), 248-257.
13. Wang, Y., Xu, H., Zheng, X., Wei, H., Sun, R., & Tian, Z. (2007). High expression of NKG2A/CD94 and low expression of granzyme B are associated with reduced cord blood NK cell activity. Cell Mol Immunol, 4(5), 377-82.
14. Condiotti, R., Zakai, Y. B., Barak, V., & Nagler, A. (2001). Ex vivo expansion of CD56+ cytotoxic cells from human umbilical cord blood. Experimental Hematology, 29(1), 104-113.
15. Alnabhan, R., Madrigal, A., & Saudemont, A. (2015). Differential activation of cord blood and peripheral blood natural killer cells by cytokines. Cytotherapy, 17(1), 73-85.
16. Cany, J., Dolstra, H., & Shah, N. (2015). Umbilical cord blood–derived cellular products for cancer immunotherapy. Cytotherapy, 17(6), 739-748.
17. Rafiq, Q. A., & Thomas, R. J. (2016). The evolving role of automation in process development & manufacture of cell & gene-based therapies. Cell and Gene Therapy Insights, 2(4), 473-479.
18. Miller, J. S., Oelkers, S., Verfaillie, C., & McGlave, P. (1992). Role of monocytes in the expansion of human activated natural killer cells.
19. Shin, M. H., Kim, J., Lim, S. A., Kim, J., Kim, S. J., & Lee, K. M. (2020). NK cell-based immunotherapies in cancer. Immune network, 20(2).
20. Parkhurst, M. R., Riley, J. P., Dudley, M. E., & Rosenberg, S. A. (2011). Adoptive Transfer of Autologous Natural Killer Cells Leads to High Levels of Circulating Natural Killer Cells but Does Not Mediate Tumor RegressionNK Adoptive Transfer in Cancer Patients. Clinical Cancer Research, 17(19), 6287-6297.
21. Cantoni, C., Huergo-Zapico, L., Parodi, M., Pedrazzi, M., Mingari, M. C., Moretta, A., … & Vitale, M. (2016). NK cells, tumor cell transition, and tumor progression in solid malignancies: new hints for NK-based immunotherapy? Journal of immunology research, 2016.
22. Igarashi, T., Wynberg, J., Srinivasan, R., Becknell, B., McCoy Jr, J. P., Takahashi, Y., … & Childs, R. W. (2004). Enhanced cytotoxicity of allogeneic NK cells with killer immunoglobulin-like receptor ligand incompatibility against melanoma and renal cell carcinoma cells. Blood, 104(1), 170-177.
23. Ruggeri, L., Capanni, M., Casucci, M., Volpi, I., Tosti, A., Perruccio, K., … & Velardi, A. (1999). Role of natural killer cell alloreactivity in HLA-mismatched hematopoietic stem cell transplantation. Blood, The Journal of the American Society of Hematology, 94(1), 333-339.
24. Ruggeri, L., Mancusi, A., Capanni, M., Urbani, E., Carotti, A., Aloisi, T., … & Velardi, A. (2007). Donor natural killer cell allorecognition of missing self in haploidentical hematopoietic transplantation for acute myeloid leukemia: challenging its predictive value. Blood, The Journal of the American Society of Hematology, 110(1), 433-440.