Phân biệt giữa MSC CM và Exosome
Phân biệt MSC CM (Môi trường điều hoà) và Exosome (thể tiết ngoại bào)
Trong nhiều năm gần đây, việc cấy ghép tế bào gốc trung mô (MSC) đã trở thành một liệu pháp hứa hẹn có khả năng điều trị nhiều bệnh khác nhau như tim mạch, tự miễn hay các bệnh lý thoái hoá gây ảnh hưởng đến thần kinh như Alzheimer, đa xơ cứng,… Hiệu quả điều trị này đã được các nhà khoa học đã chứng minh là do MSC có khả năng tiết ra hệ chất tiết gồm các yếu tố có hoạt tính sinh học như các cytokine, yếu tố tăng trưởng và các peptide [1]. Trong điều kiện in vitro, MSC tiết các hoạt chất sinh học này dưới dạng hoà tan hay đóng gói trong thể tiết ngoại bào (extracellular vesicles – EV) ra môi trường điều hoà (conditioned media – CM). Do vậy, chúng ta có thể hình dung được CM là môi trường nuôi cấy MSC, có chứa các thành phần dinh dưỡng nuôi tế bào, các phân tử hoà tan tiết ra từ MSC và thể tiết ngoại bào (EV). Còn EV là túi tiết từ MSC, chỉ chứa các hoạt chất tiết từ MSC mà không có chứa bất cứ thành phần ngoại sinh khác.
TẢI FILE PDF TẠI ĐÂY: Phân biệt giữa MSC CM và Exosome – PDF
Môi trường điều hoà từ nuôi cấy tế bào gốc trung mô và tiềm năng điều trị
MSC-CM (Hình 1) thu được từ môi trường nuôi cấy MSC in vitro là một hỗn hợp chứa các thành phần có hoạt tính sinh học như các protein hoà tan (cytokines, chemokines,…) và EV. MSC-CM có những ảnh hưởng tích cực trong điều trị rối loạn quá trình viêm của hệ thống thần kinh, tim mạch, hô hấp và xương, ví dụ như khả năng ức chế biệt hoá tế bào B thành tế bào tiết kháng thể (plasma cells) thông qua IL-1RA, tiết ra PD-1 làm ức chế sự hoạt hoá của tế bào T và tăng cường quá trình chết theo chu trình.
Hơn nữa, các thành phần có mặt trong CM như prostaglandin E2 (PGE2), TGF-β1, IL-6 and nitric oxide (NO) cũng giúp ức chế sự ảnh hưởng của tế bào T, bạch cầu trung tính và tế bào giết tự nhiên [2]. Không chỉ vậy, chúng còn cho thấy khả năng tăng cường quá trình hình thành mạch thông qua việc điều hoà hàng loạt các yếu tố như Ang-1, Ang-2, VEGF, angiostatin, CXCL16, EGF, FGF, PDGF, GM-CSF, HGF, MCP-1, MMP-8 và MMP-9 [3]. Tuy nhiên vẫn còn rất nhiều rào cản về việc sử dụng chúng trong việc thiết lập các thử nghiệm lâm sàng bởi vì chúng chứa rất nhiều thành phần chưa xác định và chưa có phương pháp phân lập hiệu quả [4]. Do vậy, một quần thể nhỏ hơn đã được định danh trong CM đang thu hút sự chú ý của các chuyên gia trong điều trị bệnh lý là thể tiết ngoại bào (EVs).
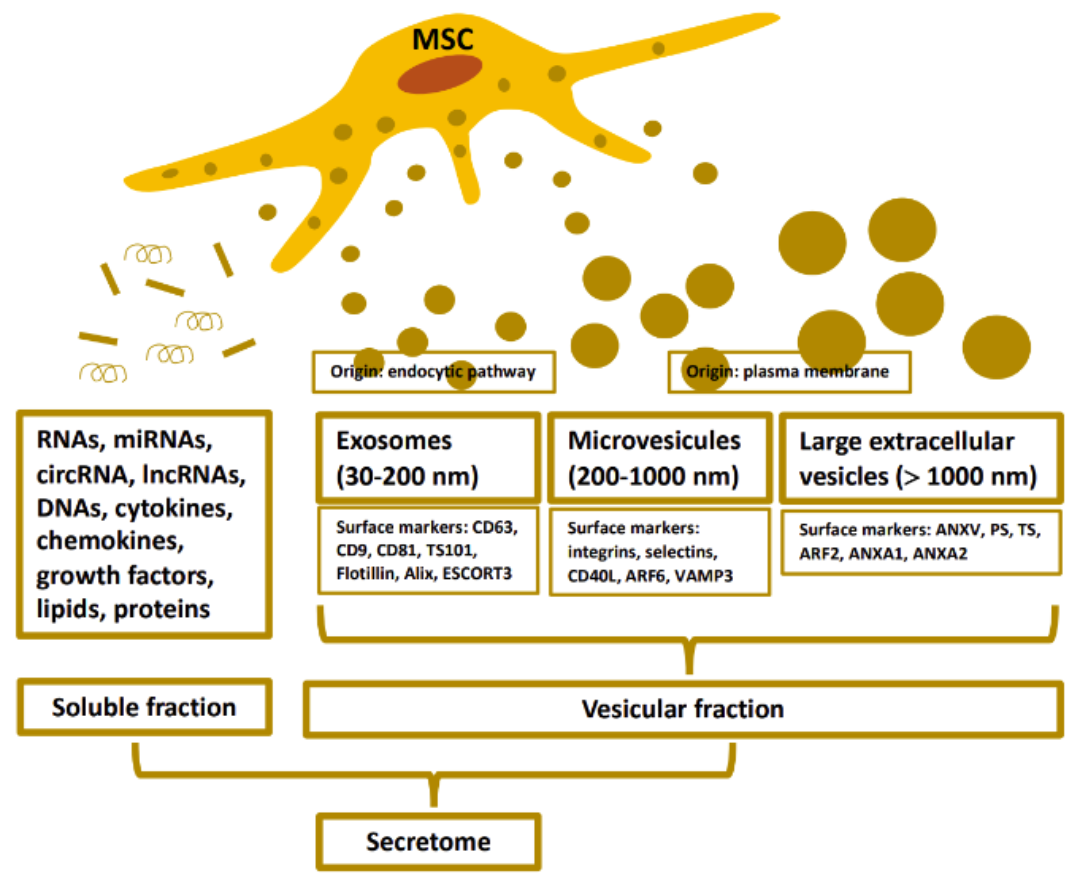
Hình 1: Các thành phần trong hệ tiết của MSC
Thể tiết ngoại bào và tiềm năng ứng dụng trong điều trị
Thể tiết ngoại bào (extracellular vesicles – EV) (Hình 2) là các túi tiết ra từ nhiều loại tế bào khác nhau, trong đó có tế bào gốc, và chúng được bọc kín bởi lớp màng lipid kép. Quần thể EV gồm có ba loại: thể chết theo chu trình tế bào apoptosis (apapoptotic body) – đây là quần thể có kích thước lớn nhất, vi bóng bào (microvesicles) – là quần thể có kích thước trung bình và exosome – là quần thể có kích thước nhỏ nhất [5]. Chúng chứa nhiều các chất có hoạt tính sinh học như yếu tố tăng tưởng, cytokine, lipid, nucleic acid (DNA, mRNA, microRNA),.. và có khả năng di chuyển theo hệ tuần hoàn của cơ thể và truyền các hoạt chất sinh học này cho tế bào đích [5].
Nhờ đặc tính độc nhất đó, EV đã được ứng dụng rất nhiều trong điều trị và thậm chí được nghiên cứu để phát triển thành túi mang và đưa thuốc. Hiện nay, ngoài khả năng tái tạo và điều hoà miễn dịch đã được chứng minh qua rất nhiều cơ chế [6], MSC-EV còn cho thấy tiềm năng trong chữa bệnh tự miễn thông qua ức chế đường truyền tín hiệu ATM/ATR/p53 bằng miR-34a giúp cải thiện tình trạng viêm trong bệnh nhân viêm khớp tự miễn (RA) [7].
Thêm vào đó, chúng cũng có khả năng chống xơ hoá ở gan, thận cũng như phổi. Ví dụ trong xơ gan, hoạt tính của MSC-EV được thể hiện thông qua việc ức chế sự biểu hiện con đường truyền tín hiệu Wnt/β-catenin, α-SMA và collagen loại I, do đó ngăn chặn sự kích hoạt tế bào hình sao (stellate cell) và tăng tái tạo tế bào gan [8]. Không chỉ có vậy, hiện nay EV còn được sử dụng như một phương tiện vận chuyển thuốc (drug vehicles) và tương lai sẽ được ứng dụng trong điều chế vaccine [9]. Mặc dù EV có nguồn gốc từ MSC đã cho thấy tiềm năng trong y học, tuy nhiên vẫn còn những rào cản về việc sử dụng EV trong thử nghiệm lâm sàng và ứng dụng trong thực tiễn điều trị. Những rào cản có thể đề cập đến đó là hạn chế trong sản xuất số lượng lớn EV và những biện pháp duy trì sự tiết EV ổn định từ tế bào, thiếu phương pháp phân lập hiệu quả EV cũng như việc kiểm soát EVs nhắm vào tế bào đích [9].
Do vậy, để có thể sản xuất ổn định EV cho mục đích thử nghiệm lâm sàng và điều trị, cần thiết phải xây dựng được quy trình kích thích MSC tiết hiệu quả EV, quy trình phân lập EV số lượng lớn, phương thức bảo quản và thiết kế EV nhắm trúng đích tế bào cần tương tác.
Hình 2: Quá trình hình thành các túi ngoại bào
Kết luận
Cả hai liệu pháp CM và EV không sử dụng tế bào này đều cho thấy tiềm năng vượt trội trong y học và giảm thiểu được những rủi ro khi sử dụng liệu pháp tế bào. Trái ngược với CM, hiện nay có rất nhiều thử nghiệm lâm sàng đánh giá tính an toàn và hiệu quả của MSC-EV. Điều này được cho là khả dĩ bởi vì người ta dễ kiểm soát hơn nguồn gốc thành phần hoạt chất trong EV, trong khi CM có chứa cả các thành phần chưa được xác định và có nguồn gốc không phải là từ tế bào gốc.
Hơn nữa, EV có khả năng di chuyển tới nhiều mô trong cơ thể mà vẫn có khả năng bảo vệ nguyên vẹn hoạt chất bên trong nó, nên EV có khả năng truyền tải thuốc điều trị tốt hơn. Mặc dù có nhiều nghiên cứu và thử nghiệm về EV hơn CM, tuy nhiên vẫn chưa có sản phẩm EV hay CM nào hiện nay được cấp phép sử dụng cho điều trị. Và hiện nay, các nghiên cứu vẫn tiếp tục được triển khai để thu thập bằng chứng khoa học có giá trị để có thể nhanh nhất ứng dụng CM và EV vào điều trị nhiều bệnh lý khác nhau.
Tài liệu tham khảo:
- Ranganath SH, Levy O, Inamdar MS, Karp JMJCsc: Harnessing the mesenchymal stem cell secretome for the treatment of cardiovascular disease. 2012, 10(3):244-258.
- Niada S, Giannasi C, Magagnotti C, Andolfo A, Brini ATJJoP: Proteomic analysis of extracellular vesicles and conditioned medium from human adipose-derived stem/stromal cells and dermal fibroblasts. 2021, 232:104069.
- Watt SM, Gullo F, van der Garde M, Markeson D, Camicia R, Khoo CP, Zwaginga JJJBmb: The angiogenic properties of mesenchymal stem/stromal cells and their therapeutic potential. 2013, 108(1):25-53.
- Ahangar P, Mills SJ, Cowin AJJIjoms: Mesenchymal stem cell secretome as an emerging cell-free alternative for improving wound repair. 2020, 21(19):7038.
- Doyle LM, Wang MZJC: Overview of extracellular vesicles, their origin, composition, purpose, and methods for exosome isolation and analysis. 2019, 8(7):727.
- Kou M, Huang L, Yang J, Chiang Z, Chen S, Liu J, Guo L, Zhang X, Zhou X, Xu XJCD et al: Mesenchymal stem cell-derived extracellular vesicles for immunomodulation and regeneration: a next generation therapeutic tool? 2022, 13(7):580.
- Wu H, Zhou X, Wang X, Cheng W, Hu X, Wang Y, Luo B, Huang W, Gu JJJoC, Medicine M: miR‐34a in extracellular vesicles from bone marrow mesenchymal stem cells reduces rheumatoid arthritis inflammation via the cyclin I/ATM/ATR/p53 axis. 2021, 25(4):1896-1910.
- Rong X, Liu J, Yao X, Jiang T, Wang Y, Xie FJScr, therapy: Human bone marrow mesenchymal stem cells-derived exosomes alleviate liver fibrosis through the Wnt/β-catenin pathway. 2019, 10:1-11.
- 9. Claridge B, Lozano J, Poh QH, Greening DWJFiC, Biology D: Development of extracellular vesicle therapeutics: Challenges, considerations, and opportunities. 2021, 9:734720.