TẾ BÀO GỐC MÁU CỐNG RỐN TRONG ĐIỀU TRỊ HỘI CHỨNG MYELOATHEXIS
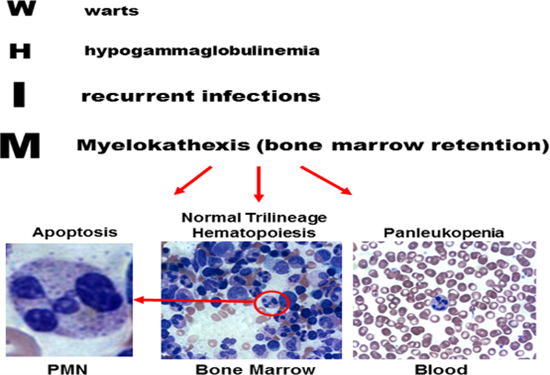
Hội chứng myelokathexis hay còn gọi là hội chứng WHIM (Warts, Hypogammaglobulinemia, Immunodeficiency, và Myelokathexis syndrome) là tình trạng suy giảm miễn dịch nguyên phát rất hiếm gặp với các đặc điểm lâm sàng đặc trưng bao gồm: mụn cóc ở trên da, nhiễm trùng tái phát, hạ đường huyết và myelokathexis (1). Là một bệnh lý rất hiếm gặp với chỉ khoảng hơn 90 trường hợp được báo cáo trên thế giới từ năm 1964 (2). Theo số liệu phân tích của trung tâm suy giảm miễn dịch nước Pháp, tỉ lệ mắc bệnh chỉ là 0,23/1 triệu ca sinh (3). Hội chứng WHIM có thể phổ biến ở phụ nữ hơn là ở nam giới, hầu hết các trường hợp bệnh nhân được báo cáo là ở Mỹ và Châu Âu. Hội chứng WHIM là bệnh được di truyền trội trên NST thường, do vậy, chúng được di truyền từ thế hệ này qua thế hệ khác theo quy luật di truyền Meden (4). Là một bệnh lý suy giảm miễn dịch, các bệnh nhân bị hội chứng WHIM thường dễ bị tổn thương do nhiễm trùng nếu không được chuẩn đoán sớm trong những năm đầu đời. Bệnh nhân WHIM có tỉ lệ cao mắc bệnh ác tính liên quan đến vi rút HPV như ung thư cổ tử cung, ung thư biểu mô. Ngoài ra, các bệnh lý khác như viêm phổi, viêm đường hô hấp, viêm nha chu, viêm tủy xương, viêm màng não quan sát thấy trên 70% bệnh nhân (5). Các phương pháp điều trị hiện nay cho bệnh nhân WHIM bao gồm: Globuline miễn dịch, G-CSF, thuốc kháng CXCR4, liệu pháp gen và cấy ghép tế bào gốc tạo máu. Cho đến hiện tại, ngoài ghép tế bào gốc tạo máu, các phương pháp khác đều không mang tính đặc hiệu, tính an toàn và hiệu quả thì cần được đánh giá thêm. Trong số các báo cáo về điều trị WHIM, chỉ có 7 bệnh nhân được ghi nhận khỏi WHIM, thì có 6 bệnh nhân được ghép tế bào gốc tạo máu, do vậy, ghép tế bào gốc tạo máu là một phương án điều trị dứt điểm và khỏi bệnh hoàn toàn cho các bệnh nhân WHIM (6). Tế bào gốc tạo máu có thể huy động từ các nguồn như máu ngoại vi, tủy xương và đặc biệt là trong máu cuống rốn (umbilical cord blood, UCB).
HỘI CHỨNG MYELOATHEXIS (WHIM) VÀ VAI TRÒ GHÉP TẾ BÀO GỐC TẠO MÁU TRONG ĐIỀU TRỊ
Hội chứng myelokathexis là thuật ngữ được dùng đầu tiên năm 1964 để miêu tả một bệnh nhi là bé gái 9 tuổi bị giảm bạch cầu bẩm sinh nghiêm trọng, mặc dù các tế bào bạch cầu đã trưởng thành hoàn toàn trong tủy xương (7). Năm 1990, Wetzler và đồng nghiệp đã đưa ra thuật ngữ WHIM để mô tả 3 người trong một gia đình đều có 4 triệu chứng: Mụn cóc, hạ đường huyết, nhiễm trùng và myelokathexis. Đây cũng là những triệu chứng điển hình của những người mắc WHIM được chuẩn đoán sau này (Hình 1) (8). Bệnh nhân WHIM rất nhạy cảm với vi rút HPV do đó thường bị mụn cóc lan rộng trên tay và chân ở độ tuổi từ 10 -20 tuổi và mụn cóc sinh dục sau khi quan hệ tình dục lần đầu tiên (9). Các đánh giá hồi cứu cho thấy 40 – 60% bệnh nhân có mụn cóc ở tay, chân ở độ tuổi trung bình là 11 tuổi, 16% các bệnh nhân bị các bệnh ác tính liên quan đến HPV như ung thư cổ tử cung, ung thư biểu mô họng (5,10). Nhiễm trùng tái phát liên tục là một đặc điểm đặc trưng của bệnh nhân WHIM do bị suy giảm miễn dịch, có hơn 90% các bệnh nhân WHIM bị nhiễm trùng và có thể bị ngay trước 1 tuổi. Nhiễm trùng đường hô hấp trên và dưới là phổ biến nhất, tiếp sau đó là viêm tai giữa và nhiễm trùng da (5). Myelokathexis là đặc điểm quan trọng nhất để chuẩn đoán bệnh nhân WHIM thông qua chọc hút tủy xương, mặc dù bị giảm bạch cầu trung tính không theo chu kì nghiêm trọng ở trong máu, nhưng kết quả sinh thiết lại cho thấy rất nhiều tế bào bạch cầu trung tính trưởng thành trong tủy xương (1,11).
Hình 1a: Bạch cầu trung tính tại máu ngoại vi (blood) và trong tủy xương của bệnh nhân WHIM
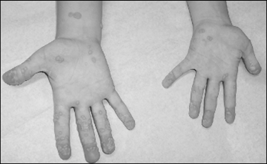
Hình 1b: Mụn cóc trên tay bệnh nhi bị WHIM
Năm 2003, nghiên cứu của Hernandez và cộng sự khi phân tích di truyền trên 3 phả hệ gia đình bị WHIM đã phát hiện ra đột biến gen mã hóa thụ thể chemokine CXCR4 nằm trên NST số 2. Đột biến này là nguyên nhân duy nhất gây bệnh lý WHIM (12). Hệ thống tín hiệu chemkine bao gồm các thụ thể và phối tử của chúng có vai trò trong việc điều phối vận chuyển bạch cầu trong hệ thống miễn dịch (13). Trong đó, thụ thể CXCR4 thường được biểu hiện hầu hết trên màng tế bào bạch cầu và có một phối tử tương ứng với nó là CXCL12 được tiết ra bởi tế bào mô đệm tủy xương và nhiều loại tế bào khác (13, 14). Chemokine CXCR4 và phối tử CXCL12 có vai trò cực kì quan trọng trong việc ức chế sự di chuyển của tế bào gốc tạo máu và tế bào bạch cầu trung tính từ tủy xương để đi vào máu, ngược lại, một thụ thể CXCR2 và phối tử của nó là CXCL8 có vai trò việc thúc đẩy các tế bào gốc tạo máu và bạch cầu trung tính đi ra khỏi tủy xương (15). Đột biến WHIM trên gen CXCR4 làm mất một số axit amin tại đầu C-terminal của thụ thể, điều này dẫn đến việc liên kết giữa CXCR4/CXCL12 được tăng lên và khếch đại tín hiệu thụ thể này, gây ra sự mất cân bằng trong điều hòa CXCR4/CXCR4/CXCL12 và CXCR2/CXCL8 (hình 2) (16). Có 11 đột biến WHIM trên gen CXCR4 được tìm thấy và tất cả đều nằm ở đầu C-terminal, các đột biến này thường gây kết thúc sớm, hoặc thêm axit amin vào đầu C-terminal thụ thể CXCR4 (17).
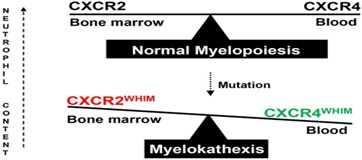
Hình 2. Sự mất cân bằng trong tín hiệu hai thụ thể CXCR4/CXCR4/CXCL12 và CXCR2/CXCL8
Phương pháp điều trị hiện nay cho WHIM có thể kể đến như: Globuline miễn dịch, G-CSF, thuốc kháng CXCR4, liệu pháp gen và cấy ghép tế bào gốc tạo máu (19). Bệnh nhân WHIM có thể dùng các sản phậm Globuline miễn dịch từ người nhằm nâng cao nồng độ IgG giúp ngăn ngừa các bệnh nhiễm trùng ở tai và phổi, tuy nhiên, cả sản phẩm này phải tiêm tĩnh mạch hoặc dưới da nhiều lần và có nguy cơ lấy nhiễm do được điều chế từ nguồn máu khác nhau. G-CSF được sử dụng để nâng số lượng bạch cầu trung tính của bệnh nhân bằng cách làm suy giảm phối tử CXCL12, tuy nhiên, việc sử dụng G-CSF với WHIM thường gây đau xương nghiêm trọng và thời gian bán hủy ngắn (18). Vì đột biến WHIM làm tăng cường hoạt động CXCR4 nên thuốc ức chế CXCR4 là một phương pháp điều trị hiệu quả, tuy nhiên, nó cần phải sử dụng suốt đời. AMD3100 là thuốc được FDA cấp phép gần đây sử dụng cho bệnh nhân đa u tủy xương đã được sử dụng điều trị cho WHIM giúp đảo ngược sự giảm bạch cầu. Thuốc được coi là an toàn khi đã có những đánh giá sau 5 năm sử dụng giúp giảm nhiễm trùng và lây nhiễm HPV (20). Ghép tế bào gốc tạo máu (hematopoietic stem cells, HSCs) là phương pháp duy nhất hiện nay có thể mang lại sự thuyên giảm lâu dài và khỏi hoàn toàn cho bệnh nhân WHIM, mặc dù việc cấy ghép có nhiều biến chứng và nguy cơ tử vong nhưng là cơ hội cho việc đẩy lùi bệnh hoàn toàn (6).
Tế bào gốc tạo máu (HSCs) là các tế bào gốc đa năng có thể tạo ra tất cả các dòng tế bào máu bao gồm cả tế bào dòng tủy (bạch cầu đơn nhân, đại thực bào, bạch cầu trung tính, basophils, bạch cầu ái toan, hồng cầu, megakaryocytes/tiểu cầu và tế bào đuôi gai) và dòng bạch huyết (Tế bào T, tế bào B, tế bào NK) (21). Ghép tế bào gốc tạo máu (Hematopoietic stem cell transplant, HSCT) liên quan đến việc truyền tĩnh mạch tế bào gốc tạo máu để thiết lập lại quá trình sản xuất tế bào máu ở những bệnh nhân có tủy xương hoặc hệ thống miễn dịch bị tổn thương và suy giảm. Hiện nay, HSCT đang là một trong những phương pháp chính đề điều trị các bệnh ác tính và không ác tính liên quan đến hệ tạo máu và miễn dịch (22). Theo cơ sở dữ liệu của Trung tâm Nghiên cứu Cấy ghép Máu và Tủy Quốc tế (CIBMTR) thu thập từ hơn 550 trung tâm tại 56 quốc gia trên toàn thế giới, bao gồm 207 trung tâm đang hoạt động và theo dõi tại Mỹ có hơn 254.663 ghép tự thân, 251.053 ca ghép có người hiến tặng có quan hệ họ hàng hoặc không có họ hàng và 15.057 ca ghép máu cuống rốn (umbilical cord blood transplantation, UCBT) đã được báo cáo trong năm 2018 (23). Máu cuống rốn đã trở thành một trong những nguồn cung cấp chính tế bào gốc tạo máu phục vụ ghép. Theo Hiệp hội tài trợ tủy thế giới (WMDA), hơn 778.000 đơn vị máu cuống rốn có sẵn trên toàn thế giới để sử dụng cho bất kỳ bệnh nhân nào có nhu cầu và khoảng 35.000 UCBT đã được thực hiện tính đến cuối năm 2019, cùng với đó là hơn 4 triệu đơn vị UCB nằm trong các ngân hàng mô tư nhân (24). UCB chứa nguồn phong phú HSCs nguyên thủy, mặc dù có sự hạn chế về số lượng HSCs thu được nhưng tỉ lệ HSCs tăng sinh, phục hồi sau ghép cao hơn các nguồn HSCs từ tủy xương và máu ngoại vi (25). UCB cũng là nguồn HSCs non trẻ nhất có thể thu thập được dễ dàng, không gây đau đớn và ảnh hưởng đến cả mẹ và bé. Do là các tế bào rất non trẻ nên chúng có biểu hiện nhiều CD34+ hơn và chiều dài telomere hơn so với các nguồn HSCs khác (26). UCB-HSC cũng có đặc tính miễn dịch chưa được phát triển đầy đủ mang lại khả năng ghép không phù hợp HLA giữa người cho và người nhận đồng thời giảm triệu chứng thải ghép chống vật chủ (GvHD) sau khi ghép (27).
ỨNG DỤNG CỦA TẾ BÀO GỐC TẠO MÁU CUỐNG RỐN TRONG ĐIỀU TRỊ HỘI CHỨNG MYELOATHEXIS (WHIM)
Do WHIM là một bệnh lý hiếm gặp với số lượng ca chuẩn đoán rất ít trên toàn thế giới vì vậy số lượng công bố điều trị cho các bệnh nhân bằng phương pháp ghép tế bào gốc còn rất hạn chế. Theo số liệu thống kê của Laberko và cộng sự thì chỉ có 7 bệnh nhân WHIM được báo cáo điều trị bằng ghép HSCs. Bệnh nhân có độ tuổi trung bình là 0,85 tuổi khi khởi phát bệnh với tình trạng giảm bạch cầu, 6/7 bệnh nhân được điều trị bằng liệu pháp Globuline miễn dịch thông thường và dùng G-CSF để điều chỉnh tình trạng giảm bạch cầu trung tính trước khi ghép (28). Có 4 bệnh nhân được ghép HSCs có nguồn gốc từ máu ngoại vi, 2 bệnh nhân từ tủy xương và 1 bệnh nhân được ghép bằng máu cuống rốn, độ tuổi trung bình khi được ghép là 3,7 tuổi (1,4 đến 9,3) tuổi, tất cả nguồn HSCs đều là ghép đồng loại từ người hiến tặng (28). Có 1 bệnh nhân đã tủ vong vì biến chứng nhiễm trùng sau hai lần ghép thất bại, 6 bệnh nhân còn lại đều đạt được thành công trong việc ghép tế bào gốc tạo từ người hiến tặng, có 5 bệnh nhân hồi phục miễn dịch và không có bất kì triệu chứng của bệnh trước đó, thời gian đánh giá trung bình trong các nghiên cứu là 6,7 năm (28).
Năm 2010, Bệnh viện Szent László, Budapest, Hungary đã thực hiện ca ghép cho bệnh nhi WHIM là một bé gái được chuẩn đoán bị hội chứng WHIM khi được 1 tuổi, bệnh nhân được xác định có đột biến gen CXCR4 c.1013C>G (29). Bệnh nhân bắt đầu được điều trị bằng các liệu pháp globuline miễn dịch thông thường và dùng G-CSF để điều trị ở thời điểm 5,5 tuổi tuy nhiên bệnh nhân liên tục bị nhiễm trùng đường hô hấp tái phát dẫn đến tắc nghẽn phổi mãn tính, vì vậy bệnh nhi được chỉ định ghép HSCs tại thời điểm 9,3 tuổi. Bệnh nhi được ghép đơn vị UCB từ người hiến là em trai có cùng huyết thống với độ phù hợp HLA là 12/12. Đơn vị UCB sau ghép chứa 1,2×105 tế bào CD34+ /kg và 3,8×107 tế bào có nhân/kg được truyền mà không có bất kỳ tác dụng phụ nào. Bệnh nhi sau ghép có hiện tượng viêm tắc nghẽn phổi bùng phát vào ngày 49 sau ghép nhưng đã được điều trị thành công, không có hiện tượng GvHD được quan sát thấy, số lượng bạch cầu bắt đầu tăng sau 32 ngày ghép. Kết quả xét nghiệm sau 55 ngày cho thấy >95% các tế bào người hiến trong máu, nồng độ globuline miễn dịch của bệnh nhân đã bình thường mà không cần bất kì thuốc bổ trợ nào. Một năm sau cấy ghép, bệnh nhân có các thông số huyết học gần như bình thường, không nhiễm trùng hoặc có biến chứng sau ghép. Đặc biệt, bệnh tắc nghẽn phổi mãn tính của bệnh nhân cũng đã khỏi hoàn toàn và không phải dùng thuốc giãn phế quản nữa (30).
HSCT ở bệnh nhân mắc hội chứng WHIM không thể được coi là phương pháp điều trị hoàn toàn an toàn và nguy cơ biến chứng liên quan đến cấy ghép đe dọa tính mạng và tử vong vẫn còn. Tuy nhiên, hiện tại không có lựa chọn điều trị nào khác có khả năng ngăn ngừa diễn biến của bệnh WHIM. Cho đến nay, HSCT đồng loài vẫn là lựa chọn điều trị duy nhất cho bệnh nhân mắc hội chứng WHIM. Cùng với đó, vai trò của UCB trong việc ghép HSCT ngày càng quan trọng do nhiều ưu điểm, đặc biệt là trong việc ghép HSCT cho các bệnh lý liên quan đến miễn dịch và huyết học.
TÀI LIỆU THAM KHẢO
1.Kawai, T., & Malech, H. L. (2009). WHIM syndrome: congenital immune deficiency disease. Current opinion in hematology, 16(1), 20.
2.Heusinkveld, L. E., Yim, E., Yang, A., Azani, A. B., Liu, Q., Gao, J. L., … & Murphy, P. M. (2017). Pathogenesis, diagnosis and therapeutic strategies in WHIM syndrome immunodeficiency. Expert opinion on orphan drugs, 5(10), 813-825.
- Beaussant Cohen, S., Fenneteau, O., Plouvier, E., Rohrlich, P. S., Daltroff, G., Plantier, I., … & Donadieu, J. (2012). Description and outcome of a cohort of 8 patients with WHIM syndrome from the French Severe Chronic Neutropenia Registry. Orphanet journal of rare diseases, 7, 1-14.
4.Huang, Y., Li, L., Chen, R., Yu, L., Zhao, S., Jia, Y., … & Zhou, L. (2023). WHIM Syndrome: Report of a Novel Familial CXCR4V340fs Gain-of-function Mutation with a Milder Phenotype.
- Dotta, L., Notarangelo, L. D., Moratto, D., Kumar, R., Porta, F., Soresina, A., … & Badolato, R. (2019). Long-term outcome of WHIM syndrome in 18 patients: high risk of lung disease and HPV-related malignancies. The Journal of Allergy and Clinical Immunology: In Practice, 7(5), 1568-1577.
6.Majumdar, S., & Murphy, P. M. (2018). Adaptive immunodeficiency in WHIM syndrome. International journal of molecular sciences, 20(1), 3.
- Zuelzer, W. W., Evans, R. K., & Goodman, J. (1964). Myelokathexis—a new form of chronic granulocytopenia: report of a case. New England Journal of Medicine, 270(14), 699-704.
- Wetzler, M., Talpaz, M., Kleinerman, E. S., King, A., Huh, Y. O., Gutterman, J. U., & Kurzrock, R. (1990). A new familial immunodeficiency disorder characterized by severe neutropenia, a defective marrow release mechanism, and hypogammaglobulinemia. The American journal of medicine, 89(5), 663-672.
- Pastrana, D. V., Peretti, A., Welch, N. L., Borgogna, C., Olivero, C., Badolato, R., … & Buck, C. B. (2018). Metagenomic discovery of 83 new human papillomavirus types in patients with immunodeficiency. mSphere 3: e00645-18.
- Geier, C. B., Ellison, M., Cruz, R., Pawar, S., Leiss-Piller, A., Zmajkovicova, K., … & Walter, J. E. (2022). Disease progression of WHIM syndrome in an international cohort of 66 pediatric and adult patients. Journal of Clinical Immunology, 42(8), 1748-1765.
- Aprikyan, A. A., Liles, W. C., Park, J. R., Jonas, M., Chi, E. Y., & Dale, D. C. (2000). Myelokathexis, a congenital disorder of severe neutropenia characterized by accelerated apoptosis and defective expression of bcl-x in neutrophil precursors. Blood, The Journal of the American Society of Hematology, 95(1), 320-327.
- Hernandez, P. A., Gorlin, R. J., Lukens, J. N., Taniuchi, S., Bohinjec, J., Francois, F., … & Diaz, G. A. (2003). Mutations in the chemokine receptor gene CXCR4 are associated with WHIM syndrome, a combined immunodeficiency disease. Nature genetics, 34(1), 70-74.
- Bachelerie, F., Ben-Baruch, A., Burkhardt, A. M., Combadiere, C., Farber, J. M., Graham, G. J., … & Zlotnik, A. (2014). International Union of Pharmacology. LXXXIX. Update on the extended family of chemokine receptors and introducing a new nomenclature for atypical chemokine receptors. Pharmacological reviews, 66(1), 1.
- Busillo, J. M., & Benovic, J. L. (2007). Regulation of CXCR4 signaling. Biochimica et Biophysica Acta (BBA)-Biomembranes, 1768(4), 952-963.
- Martin, C., Burdon, P. C., Bridger, G., Gutierrez-Ramos, J. C., Williams, T. J., & Rankin, S. M. (2003). Chemokines acting via CXCR2 and CXCR4 control the release of neutrophils from the bone marrow and their return following senescence. Immunity, 19(4), 583-593.
- Lagane, B., Chow, K. Y., Balabanian, K., Levoye, A., Harriague, J., Planchenault, T., … & Bachelerie, F. (2008). CXCR4 dimerization and β-arrestin–mediated signaling account for the enhanced chemotaxis to CXCL12 in WHIM syndrome. Blood, The Journal of the American Society of Hematology, 112(1), 34-44.
- McDermott, D. H., & Murphy, P. M. (2019). WHIM syndrome: Immunopathogenesis, treatment and cure strategies. Immunological reviews, 287(1), 91-102.
- Badolato, R., Donadieu, J., & WHIM Research Group. (2017). How I treat warts, hypogammaglobulinemia, infections, and myelokathexis syndrome. Blood, The Journal of the American Society of Hematology, 130(23), 2491-2498.
- McDermott, D. H., & Murphy, P. M. (2019). WHIM syndrome: Immunopathogenesis, treatment and cure strategies. Immunological reviews, 287(1), 91-102.
- de Wit, R. H., Heukers, R., Brink, H. J., Arsova, A., Maussang, D., Cutolo, P., … & Smit, M. J. (2017). CXCR4-specific nanobodies as potential therapeutics for WHIM syndrome. Journal of Pharmacology and Experimental Therapeutics, 363(1), 35-44.
- Arai, F., & Suda, T. (2007). Maintenance of quiescent hematopoietic stem cells in the osteoblastic niche. Annals of the New York Academy of Sciences, 1106(1), 41-53.
- Khaddour, K., Hana, C. K., & Mewawalla, P. (2019). Hematopoietic stem cell transplantation.
- D’Souza, A., Fretham, C., Lee, S. J., Arora, M., Brunner, J., Chhabra, S., … & Horowitz, M. M. (2020). Current use of and trends in hematopoietic cell transplantation in the United States. Biology of Blood and Marrow Transplantation, 26(8), e177-e182.
- Zhu, X., Tang, B., & Sun, Z. (2021). Umbilical cord blood transplantation: Still growing and improving. Stem cells translational medicine, 10(S2), S62-S74.
- Wang, J. C., Doedens, M., & Dick, J. E. (1997). Primitive human hematopoietic cells are enriched in cord blood compared with adult bone marrow or mobilized peripheral blood as measured by the quantitative in vivo SCID-repopulating cell assay. Blood, The Journal of the American Society of Hematology, 89(11), 3919-3924.
- Gupta, A. O., & Wagner, J. E. (2020). Umbilical cord blood transplants: current status and evolving therapies. Frontiers in Pediatrics, 8, 570282.
- Rocha, V., Wagner Jr, J. E., Sobocinski, K. A., Klein, J. P., Zhang, M. J., Horowitz, M. M., & Gluckman, E. (2000). Graft-versus-host disease in children who have received a cord-blood or bone marrow transplant from an HLA-identical sibling. New England Journal of Medicine, 342(25), 1846-1854.
- Laberko, A., Deordieva, E., Krivan, G., Goda, V., Bhar, S., Kawahara, Y., … & Shcherbina, A. (2022). Multicenter experience of hematopoietic stem cell transplantation in WHIM syndrome. Journal of Clinical Immunology, 1-12.
- Alapi, K., Erdős, M., Kovács, G., & Maródi, L. (2007). Recurrent CXCR4 sequence variation in a girl with WHIM syndrome. European journal of haematology, 78(1), 86-88.
- Bhar, S., Yassine, K., Martinez, C., Sasa, G. S., Naik, S., Mahoney Jr, D., … & Leung, K. S. (2015). Allogeneic stem cell transplantation in a pediatric patient with Whim syndrome. Blood, 126(23), 5528.
