Tế bào gốc máu cuống rốn trong điều trị bệnh lý Waldenström
Theo tổ chức ý tế thế giới, bệnh Waldenström hay còn gọi là bệnh lý tăng globuline đại phân tử (Waldenström macroglobulinemia, WM) là một dạng của ung thư lympho không Hodgkin liên quan đến protein globuline miễn dịch đơn dòng IgM (1). Là một dạng ung thư rất hiếm gặp, tỉ lệ mắc bệnh ở nam và nữ giới lần lượt là 0,92 và 0,32 trên 100.000 người một năm. Độ tuổi trung bình được chuẩn đoán là 71 tuổi. Các số liệu nghiên cứu cho thấy tỉ lệ mắc bệnh này không thay đổi trong hơn 50 năm qua (2). Theo số liệu của Viện nghiên cứu ung thư Hoa Kỳ, từ năm 1980 đến năm 2016 có 5784 bệnh nhân mắc WM, trong đó, tỉ lệ người da trắng mắc bệnh chiếm 88,01% tổng số ca mắc, cao hơn rất nhiều so với người da màu. Tỉ lệ sống sót sau 5 năm điều trị của bệnh nhân WM cũng tăng từ 47,84% lên 69,41% trong khoảng thời gian từ 1980 đến 2016 (3). Các phương pháp điều trị cho bệnh nhân mắc WM phổ biến hiện nay chủ yếu dựa trên 3 phương pháp chính là: Liệu pháp hóa trị miễn dịch, phác đồ dựa trên chất ức chế protea-some và phác đồ dựa trên chất ức chế BTK (4). Các phương pháp trên đều mang lại kết quả điều trị tích cực do WM là một bệnh cực kì nhạy cảm với hóa chất, cho nên bệnh nhân có tỉ lệ đáp ứng tổng thể (ORR) đạt từ 52% đến 96% cho lần trị liệu đầu tiên (5). Tuy nhiên, hầu hết các bệnh nhân cuối cùng đều tái phát sau khi hóa trị liệu lần 1, vì vậy, cần có một phương pháp điều trị giúp thuyên giảm lâu dài và khỏi hoàn toàn cho các bệnh nhân WM (1). Ghép tế bào gốc tạo máu (hematopoietic stem cell, HSC) là một hướng điều trị có thể mang lại huyên giảm lâu dài và khỏi hoàn toàn cho bệnh nhân WM, trong đó, máu cuống rốn là một ứng viên quan trọng cho nguồn cung cấp HSC phục vụ ghép.
BỆNH LÝ WALDENSTRÖM VÀ VAI TRÒ CỦA GHÉP TẾ BÀO GỐC TẠO MÁU TRONG ĐIỀU TRỊ
Waldenström macroglobulinemia (WM) được biết đến là bệnh ung thư hiếm gặp liên quan đến tế bào lympho B. Tế bào huyết tương hay tế bào plasma là một loại tế bào bạch cầu có khả năng tạo ra globulin miễn dịch IgM – một loại protein được gọi là kháng thể giúp cơ thể chống lại nhiễm trùng, chúng là dạng trưởng thành nhất của tế bào lympho B. Tuy nhiên, ở bệnh WM, các tế bào lympho B trong tủy xương phát triển thành tế bào ung thư ngay trước khi nó trở thành tế bào plasma. Các tế bào ung thư này tăng sinh không kiểm soát dẫn đến việc sản xuất rất nhiều IgM đơn dòng và làm tăng độ nhớt của máu (6) (hình 1). Các đột biến gen soma có liên quan đến WM đã được tìm thấy dựa trên giải trình tự hệ gen thế hệ mới giúp cho việc lựa chọn phương pháp điều trị phù hợp với từng bệnh nhân. Gen MY88 là gen có vai trò trong việc biệt hóa tủy xương, việc thay đổi nucleotide từ T→C tại vị trí 38.182.641 của gen MY88 trên nhiễm sắc thể 3p22.2 gây ra đột biến thay thế axit amin Leucine thành Proline là một trong những nguyên nhân gây ra ung thư ở tế bào lympho B. Đột biến này có thể tìm thấy ở 95% bệnh nhân mắc WM. Đột biến trên gen CXCR4 có thể xuất hiện 40% các bệnh nhân WM, là nguyên nhân gây ra việc tăng độ nhớt ở bệnh WM (7). Ngoài ra còn một nghiên cứu chỉ ra có sự liên quan của người mắc bệnh WM với biến đổi locus 6p21.3 trên nhiễm sắc thể số 6 (8). Các dấu hiệu lâm sàng của WM khá mờ nhạt do bệnh diễn ra âm thầm và tiến triển chậm, một số dấu hiệu có thể có người bệnh như: sốt, đổ mồ hôi về đêm, sụt cân. Ngoài ra, một số bệnh nhân có biểu hiện mệt mỏi do thiếu máu vì liên quan đến tủy xương (9). Tiêu chuẩn để chuẩn đoán WM theo tổ chức Y tế thế giới WHO bảo gồm: (a) có sự hiện diện của macroglobulin IgM trong máu, (b) có xâm lấn tủy xương bởi các tế bào huyết tương, (c) Sinh thiết tủy xương có sự xuất hiện gian bào và (d) có tế bào miễn dịch có kiểu hình đặc thù cho WM gồm: IgM+, CD19+, CD20+, CD22+, CD25+, CD27+, FMC7+, CD10–, CD23–, CD103– và CD108–.
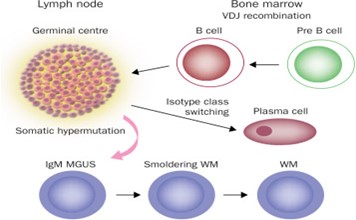
Hình 1: Sự phát triển tế bào Lympho B trong tủy xương thành tế bào ung thư WM
Dựa vào tình trạng của bệnh nhân mắc WM như: tình trạng toàn thân, tình trạng thiếu máu, kích thước của hạch bạch huyết và mức độ nhớt của máu mà các bác sĩ sẽ tiến hành điều trị, các phương pháp điều trị chính cho WM có thể nó đến như: (a) Sử dụng thuốc kháng kháng thể CD20 như Rituximab do các tế bào ung thư WM đều biểu hiện đồng đều CD20+; (b) hóa trị liệu miễn dịch như sử dụng Bendamustine-Rituximab hoặc các chất như (BR); (c) Chất ức chế BTK như Ibrutinib, một chất ức chế thụ thể BTK trên màng tế bào lympho bằng cách liên kết cộng hóa trị với dư lượng cystein tại vị trí hoạt động của enzyme BTK; (d) Thuốc ức chế Proteasome (PI) Bortezomib là PI được nghiên cứu nhiều nhất, dùng đơn độc hoặc kết hợp với rituximab và/hoặc dexamethasone để kiểm soát WM. Các phương pháp trên cho thấy khả năng đáp ứng toàn diện (ORR) của bệnh từ 52% đối với Rituximab hoặc có ORR trên 90% khi điều trị với Bortezomib, Ibrutinib và Bendamustine-Rituximab trong lần điều trị đầu tiên (10). Tuy nhiên, việc các bệnh nhân sẽ tái phát sau lần điều trị lần đầu là rất cao, hơn nữa, đối với các trường hợp có nguy cơ cao và không đáp ứng hóa chất thì cần phương pháp mới để điều trị, ghép tế bào gốc tạo máu cho bệnh nhân WM là một trong những lựa chọn (11).
Tế bào gốc tạo máu là các tế bào nguyên thủy đa năng có thể phát triển thành tất cả các loại tế bào máu, bao gồm cả tế bào dòng tủy và dòng bạch huyết (12) (hình 2). Chúng có thể tìm thấy trong một số cơ quan như: Máu ngoại vi (peripheral blood, PB), tủy xương (bone marrow, BM) và máu cuống rốn (Umbilical cord blood, UCB). Trong đó, UCB-HSC là một trong những nguồn cung cấp HSC cho những bệnh nhân cần ghép tế bào gốc nhưng không có người hiến tặng phù hợp (13). UCB-HSC mang những ưu điểm như: an toàn và dễ dàng trong thu thập mà không ảnh hưởng đến mẹ và bé, tỉ lệ xuất hiện thải ghép chống vật chủ (GvHD) thấp hơn so với các nguồn khác do UC-HSC thường khá đơn giản về mặt miễn dịch, nó cũng cho phép việc ghép khi có không có sự phù hợp HLA ở một mức độ nhất định (14). Hơn nữa, các ngân hàng mô hiện nay càng ngày càng phổ biến cho nên việc lưu trữ máu cuống rốn rất thuận tiện, tạo nên một nguồn cung cấp sẵn có khi cần ghép tế bào gốc tạo máu.
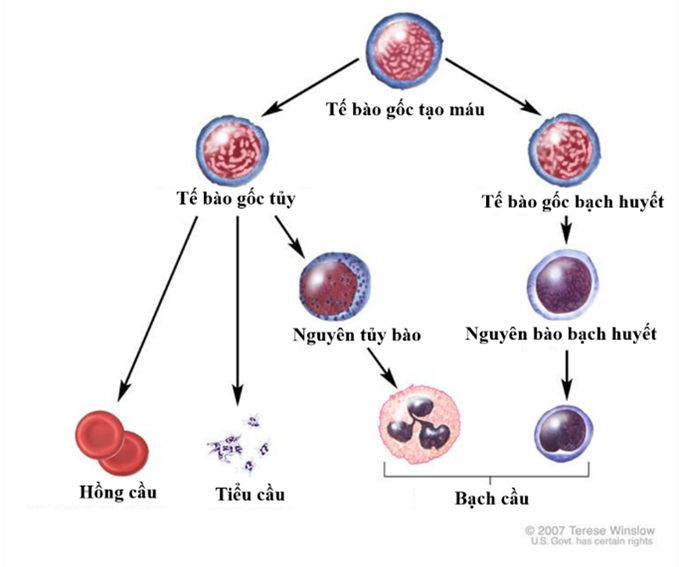
Hình 2: Tế bào gốc tạo máu và khả năng phát triển thành tất cả các tế bào của hệ tạo máu của chúng
Ghép tế bào gốc tạo máu đã được tiến hành từ khá sớm cho các bệnh nhân WM có diễn tiến nặng, Bệnh viện de la Santa Creu i Sant Pau, Barcelona, Tây Ban Nha đã tiến hành ghép HSCs một bệnh nhân nữ, 34 tuổi, chuẩn đoán WM với IgM là 17g/l, sinh thiết hạch bạch huyết thấy u lympho tế bào lympho nhỏ lan tỏa với sự biệt hóa tế bào lympho-plasma. Bệnh nhân trải qua sáu chu kì hóa trị nhưng không có phản hồi, IgM đơn dòng tăng 50g/l. Bệnh nhân được chỉ định ghép BM-HSC từ tủy xương của người anh trai phù hợp HLA. Sau 3 tháng ghép, các tế bào máu có nguồn gốc từ người hiến đã xuất hiện hoàn chỉnh trong máu ngoại vi và cả dịch tủy xương của người nhận và chỉ số IgM giảm dần chỉ còn 2,25mg/l ở lần theo dõi cuối cùng. Kết quả đánh giá cuối cùng sau 3378 ngày sau ghép bệnh nhân đều bình thường (15). Theo số liệu báo cáo của trung tâm nghiên cứu cấy ghép máu và tủy quốc tế (Center for International Blood and Marrow Transplant Research, CIBMTR) tổng hợp về việc ghép tế bào gốc tạo máu tự thân hoặc đồng loại từ hơn 450 trung tâm trên toàn thế giới cho bệnh nhân WM. Từ năm 1986 đến năm 2002 có 36 bệnh nhân được ghép HSCs cho WM từ 24 trung tâm y tế của 7 quốc gia, trong đó 26 bệnh nhân ghép đồng loài và 10 bệnh nhân ghép HSCs tự thân. Các bệnh nhân có độ tuổi trung bình 51 tuổi, thời gian trung bình từ lúc chuẩn đoán ghép HSCs là 29 tháng, 78% bệnh nhân đã trải qua 2 lần điều trị hóa chất trở lên. Sau khi ghép HSCs từ máu ngoại vi hoặc tủy xương, thời gian theo dõi sau ghép 65 tháng. Trong số 36 bệnh nhân có 42% còn sống. Số ca tử vong ở nhóm HSCs đồng loài chiếm 29% số ca tử vong và 25% số ca tử vong ở nhóm HSCs tự thân. Tỉ lệ tái phát bệnh sau 3 năm là 29% ở nhóm đồng loại và 24% ở tự thân. Tỉ lệ bệnh nhân còn sống và không tiến triển bệnh sau 3 năm là 46% ở nhóm đồng loại và 70% ở nhóm tự thân. Tỉ lệ đáp ứng hoàn toàn lui bệnh ở các bệnh nhân trong 100 ngày đầu tiên lên đến 58% cho thấy việc ghép HSCs là phương pháp tốt cho các bệnh nhân bị WM kháng trị và đặc biệt là ở độ tuổi khá trẻ (16).
ỨNG DỤNG TẾ BÀO GỐC MÁU CUỐNG RỐN TRONG ĐIỀU TRỊ WALDENSTRÖM
Kể từ ca ghép máu cuống rốn thành công đầu tiên (Umbilical cord blood transplantation, UCBT) được thực hiện trên một cậu bé 5 tuổi mắc bệnh thiếu máu Fanconi vào năm 1988 tại Bệnh viện Saint-Louis ở Paris, Pháp (17). UCBT vẫn là một trong những liệu pháp hiệu quả để chữa các bệnh ác tính, không ác tính, huyết học và chuyển hóa. Khoảng 70% số ca cần ghép HSCs không tìm được người hiến có HLA phù hợp. Theo hiệp hội tài trợ tủy thế giới (World Marrow Donor Association, WMDA) có hơn 778.000 đơn vị máu cuống rốn trên thế giới sẵn sàng để sử dụng cho bất kì bệnh nhân nào cần và khoảng 35.000 ca ghép máu cuống rốn đã được thực hiện tính đến năm 2019 (18). Đối với bệnh nhân bị WM, việc các công bố sử dụng UCB để điều trị đang còn hạn chế. Một phần là do các phương pháp điều trị bằng hóa chất hiện nay có tỉ lệ đáp ứng và thời gian sống sau 5-10 năm khi điều trị là khá cao. Cùng với đó với đó là việc ghép HSCs cũng có tỉ lệ tử vong nhất định, vậy nên, việc ghép HSCs chỉ được chỉ định cho bệnh nhân không đáp ứng thuốc và tiến triển nặng (19). Một nghiên cứu của Sakurai và cộng sự năm 2020 dựa trên số liệu của Hiệp hội truyền máu Nhật Bản về các trường hợp bệnh nhân WM được ghép HSCs từ năm 1997 đến năm 2016 tại Nhật Bản, có 77 bệnh nhân được tiến hành phân tích, trong đó có 46 bệnh nhân ghép HSCs tự thân từ nguồn tủy xương hoặc máu ngoại vi, 31 bệnh nhân được ghép đồng loại, trong đó có 8 trường hợp ghi nhận ghép bằng nguồn UCB hiến tặng. Kết quả cấy ghép cho thấy nhóm bệnh nhân được ghép HSCs đồng loại có thời gian mọc mảnh ghép trung bình là 19 ngày sau ghép, có 2 bệnh nhân ghép UCB và 1 bệnh nhân ghép BM-HSC đã tử vong sau 40 ngày ghép. Các bệnh nhân còn lại đều sống sót sau 33 tháng sau ghép cho lần xét nghiệm cuối cùng. Các kết quả ghi nhận sau đó cho thấy tỉ lệ tái phát/tiến triển sau 3 năm ở nhóm bệnh nhân ghép đồng loại chỉ là 20%, trong khi đó ở nhóm ghép tự thân lên đến 26,3%. Kết quả này cho thấy, ghép HSCs đồng loại trong đó có cả UCB mặc dù có tỉ lệ tử vong cao hơn so với việc ghép HSCs tự thân nhưng lại đem lại khả năng sống sót ổn định lâu dài hơn (20).
WM là một bệnh có diễn biến âm thầm và tiến triển chậm, vì vậy hiện nay các liệu pháp hóa trị/hóa chất vẫn đang mang lại kết quả điều trị tốt nhưng cũng có nhược điểm khi tỉ lệ tái phát là rất cao. Sử dụng tế bào gốc tạo máu nói chung và máu cuống rốn nói riêng là một phương pháp điều trị khả qua cho bệnh nhân không đáp ứng với hóa chất, bệnh nhân tái phát sau 2-3 lần hóa trị giúp bệnh nhân đẩy lùi bệnh một cách lâu dài và bền vững. Tuy chưa có nhiều công bố chi tiết về hiệu quả, tính an toàn để chứng minh tính khả thi cho việc ghép UCB cho bệnh nhân WM nhưng trong bối cảnh khoa học phát triển đặc biệt là về tế bào và sinh học phân tử, có thể hy vọng đây là phương pháp được sử dụng phổ biến và an toàn trong tương lai.
TÀI LIỆU THAM KHẢO
- Owen, R. G., Treon, S. P., Al-Katib, A., Fonseca, R., Greipp, P. R., McMaster, M. L., … & Dimopoulos, M. A. (2003, April). Clinicopathological definition of Waldenstrom’s macroglobulinemia: consensus panel recommendations from the Second International Workshop on Waldenstrom’s Macroglobulinemia. In Seminars in oncology (Vol. 30, No. 2, pp. 110-115). WB Saunders.
- Kyle RA, Larson DR, McPhail ED, et al. Fifty-year incidence of Waldenstrom Macroglobulinemia in Olmsted County, Minnesota, from 1961 through 2010: a population-based study with complete case capture and hematopathologic review. Mayo Clin Proc. 2018; 93: 739-746.
3. Yin, X., Chen, L., Fan, F., Yan, H., Zhang, Y., Huang, Z., Sun, C., & Hu, Y. (2020). Trends in Incidence and Mortality of Waldenström Macroglobulinemia: A Population-Based Study. Frontiers in oncology, 10, 1712. https://doi.org/10.3389/fonc.2020.01712
- Castillo, J. J., Allan, J. N., Siddiqi, T., Advani, R. H., Meid, K., Leventoff, C., … & Treon, S. P. (2022). Venetoclax in previously treated Waldenström macroglobulinemia. Journal of Clinical Oncology, 40(1), 63-71.
- Hivert, B., Tamburini, J., Vekhoff, A., Tournilhac, O., Leblond, V., & Morel, P. (2011). Prognostic value of the International Scoring System and response in patients with advanced Waldenström macroglobulinemia. Haematologica, 96(5), 785.
- Wang, W., & Lin, P. (2020). Lymphoplasmacytic lymphoma and Waldenström macroglobulinaemia: clinicopathological features and differential diagnosis. Pathology, 52(1), 6-14.
- Treon, S. P., Xu, L., Guerrera, M. L., Jimenez, C., Hunter, Z. R., Liu, X., … & Castillo, J. J. (2020). Genomic landscape of Waldenström macroglobulinemia and its impact on treatment strategies. Journal of Clinical Oncology, 38(11), 1198.
- Schop, R. F., Van Wier, S. A., Xu, R., Ghobrial, I., Ahmann, G. J., Greipp, P. R., … & Fonseca, R. (2006). 6q deletion discriminates Waldenström macroglobulinemia from IgM monoclonal gammopathy of undetermined significance. Cancer genetics and cytogenetics, 169(2), 150-153.
- Cao, X., Medeiros, L. J., Xia, Y., Wang, X., Thomas, S. K., Loghavi, S., … & Young, K. H. (2016). Clinicopathologic features and outcomes of lymphoplasmacytic lymphoma patients with monoclonal IgG or IgA paraprotein expression. Leukemia & Lymphoma, 57(5), 1104-1113.
- Ravi, G., & Kapoor, P. (2022). Current approach to Waldenström Macroglobulinemia. Cancer Treatment and Research Communications, 31, 100527.
- Castillo, J. J., Advani, R. H., Branagan, A. R., Buske, C., Dimopoulos, M. A., D’Sa, S., … & Kastritis, E. (2020). Consensus treatment recommendations from the tenth International Workshop for Waldenström Macroglobulinaemia. The Lancet Haematology, 7(11), e827-e837.
- Till, J. E., & McCuUock, E. A. 11961. A direct measurement of the radiation sensitivity of normal mouse bone marrow cells. Radiation Res, 14, 213.
- Munoz, J., Shah, N., Rezvani, K., Hosing, C., Bollard, C. M., Oran, B., … & Shpall, E. J. (2014). Concise review: umbilical cord blood transplantation: past, present, and future. Stem cells translational medicine, 3(12), 1435-1443.
- Malard, F., Milpied, N., Blaise, D., Chevallier, P., Michallet, M., Lioure, B., … & Mohty, M. (2015). Effect of graft source on unrelated donor hemopoietic stem cell transplantation in adults with acute myeloid leukemia after reduced-intensity or nonmyeloablative conditioning: a study from the Societe Francaise de Greffe de Moelle et de Therapie Cellulaire. Biology of Blood and Marrow Transplantation, 21(6), 1059-1067
- Martino, R., Shah, A., Romero, P., Brunet, S., Sierra, J., Domingo-Albos, A., … & Isola, L. (1999). Allogeneic bone marrow transplantation for advanced Waldenstrom’s macroglobulinemia. Bone marrow transplantation, 23(7), 747-749..
- Anagnostopoulos, A., Hari, P. N., Pérez, W. S., Ballen, K., Bashey, A., Bredeson, C. N., … & Giralt, S. A. (2006). Autologous or allogeneic stem cell transplantation in patients with Waldenstrom’s macroglobulinemia. Biology of Blood and Marrow Transplantation, 12(8), 845-854.
- Gluckman, E., Broxmeyer, H. E., Auerbach, A. D., Friedman, H. S., Douglas, G. W., Devergie, A., … & Boyse, E. A. (1989). Hematopoietic reconstitution in a patient with Fanconi’s anemia by means of umbilical-cord blood from an HLA-identical sibling. New England Journal of Medicine, 321(17), 1174-1178.
- Zhu, X., Tang, B., & Sun, Z. (2021). Umbilical cord blood transplantation: Still growing and improving. Stem cells translational medicine, 10(S2), S62-S74.
- Cornell, R. F., Bachanova, V., D’Souza, A., Woo-Ahn, K., Martens, M., Huang, J., … & Hari, P. (2017). Allogeneic transplantation for relapsed Waldenström macroglobulinemia and lymphoplasmacytic lymphoma. Biology of Blood and Marrow Transplantation, 23(1), 60-66.
- Sakurai, M., Mori, T., Uchiyama, H., Ago, H., Iwato, K., Eto, T., … & Suzuki, R. (2020). Outcome of stem cell transplantation for Waldenström’s macroglobulinemia: analysis of the Japan Society for Hematopoietic Cell Transplantation (JSHCT) Lymphoma Working Group. Annals of Hematology, 99, 1635-1642.
