Tế bào gốc tạo máu trong điều trị hội chứng omenn
Hội chứng Omenn là bệnh hiếm thuộc nhóm bệnh suy giảm miễm dịch phối hợp trầm trọng (SCID – Severe Combine Immunodeficiency) liên quan đến rối loạn miễn dịch tiên phát dẫn đến sự thiếu hụt kết hợp miễn dịch nghiêm trọng và có nguy cơ tử vong rất cao nếu không được điều trị (1). Là một bệnh do gen lặn gây ra trên nhiễm sắc thể (NST) thường và thường biểu hiện rất sớm ở trẻ sơ sinh từ lúc chào đời hoặc khoảng trước 8 tuần tuổi, tỉ lệ xuất hiện bệnh là 1/5.000.000 trẻ sơ sinh và tỉ lệ mắc bệnh ở bé trai là cao hơn so với bé gái (2). Biểu hiện ban đầu ở trẻ sơ sinh bị bệnh đó là: viêm da tróc vảy, gan to, lách to, rụng tóc, tiêu chảy, chậm phát triển và nhiễm trùng tái phát liên tục, 80% các bệnh nhân đều có các triệu chứng trên (3). Trong những năm đầu đời, nếu như trẻ sơ sinh không được chuẩn đoán và điều trị thì tỉ lệ tử vong sẽ rất cao chỉ sau 6 tháng đầu đời. Hiện nay, các phương pháp điều trị phổ biến cho SCID nói chung và hội chứng Omenn nói riêng đó là: ghép tế bào gốc tạo máu, liệu pháp gen, liệu pháp thay thế enzyme và hóa trị (4). Phương pháp ghép tế bào gốc tạo máu là hướng điều trị đầu tiên cho hội chứng Omenn và có khả năng khỏi vĩnh viễn (3). Các nguồn cung cấp tế bào gốc tạo máu có thể từ: tủy xương, máu ngoại vi hoặc máu cuống rốn. Trong đó, sử dụng tế bào gốc tạo máu từ máu cuống rốn (cord blood stem cell) phục vụ ghép có nhiều ưu điểm trong việc thu thập, lưu trữ và ghép.
HỘI CHỨNG OMENN VÀ TẾ BÀO GỐC TẠO MÁU TỪ MÁU CUỐNG RỐN
Suy giảm miễn dịch kết hợp nghiêm trọng (SICD) là tình trạng suy giảm miễn dịch nguyên phát do đột biến di truyền gây ra khiếm khuyết trong quá trình biệt hóa từ tế bào gốc tạo máu thành tế bào Lympho T, lympho B trưởng thành dẫn đến chức năng của chúng bị suy giảm hoặc không đủ số lượng. Trẻ sinh ra với hệ thống miễn dịch không có chức năng dẫn đến dễ bị nhiễm trùng nặng và tử vong ngay trong những tháng đầu đời (5). Là một bệnh gây ra do đột biến gen lặn trên NST thường, do đó, đối với trẻ sơ sinh bị SCID cần có sự đột biến gen đó trên cả hai NST. Có gần 20 loại suy giảm miễn dịch trầm trọng khác nhau, chúng được phân loại dựa trên gen bị đột biến và các kiểu hình lymphocyte bất thường đi kèm với chúng (6). Hội chứng Omenn là một dạng SCID được đặc trưng bởi các tế bào T xâm nhập vào mô, da tạo các vết ban đỏ toàn thân khi mới sinh, kèm theo đó là các đặc điểm liên quan đến hệ bạch huyết như gan to, lách to và có sự hiện diện của IgE và bạch cầu ái toan trong máu (7) (hình 1A và B). Nguyên nhân ban đầu gây ra bệnh phần lớn là đột biến lặn trên hai gen RAG1 hoặc RAG2, đây là hai gen có liên quan đến việc mã hóa enzyme tái tổ hợp RAG1 và RAG2 có vai trò hình thành tổ hợp V(D)J (Variable, Diversity, Joining) phục vụ cho sự trưởng thành của tế bào lympho T và lympho B. Việc phức hợp V(D)J không hình thành dẫn đến thiếu hụt trầm trọng sự hiện diện và chức năng của tế bào lympho T, lympho B trong máu và các cơ quan. Từ đó gây ra hiện tượng nhiễm trùng liên tục, có đến 49% trẻ sơ sinh tử vong khi được chuẩn đoán bị hội chứng Omenn (8). Theo hiệp hội điều trị suy giảm miễn dịch nguyên phát (PIDTC) năm 2022, các tiêu chí để chuẩn đoán hội chứng Omenn đó là: lượng vòng tròn thụ thể tế bào T (T cell receptor excision circles – TREC) trong máu ngoại vi bất thường, số lượng bạch cầu ái toan tăng cao, IgE tăng cao, xuất hiện hạch bạch huyết, lách, gan to và có các tế bào T oligoclonal (9). Phương pháp điều trị duy nhất hiện nay cho hội chứng Omenn đó là ghép tế bào gốc tạo máu (10). Nguồn tế bào gốc này có thể từ tủy xương người hiến tặng hoặc nguồn từ tế bào gốc máu cuống rốn phù hợp.
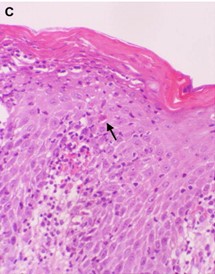
Hình 1A: Các tế bào lympho T xâm nhập và tế bào da gây đỏ, tróc vảy
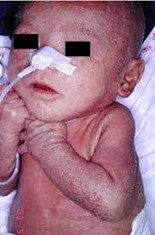
Hình 1B: Trẻ sơ sinh mắc hội chứng Omenn có da đỏ, tróc vảy, rụng tóc khi sinh
Máu cuống rốn là lượng máu còn lại trên bánh nhau và dây rốn khi em bé ra đời. Trước đây, máu cuống rốn được xem là rác thải sinh học và bị loại bỏ, tuy nhiên, đây lại là nguồn cung cấp tế bào gốc tạo máu (Hematopoietic stem cell, HSC) tương tự với máu ngoại vi và tủy xương, thậm chí còn mang nhiều ưu điểm vượt trội hơn (11). Tế bào gốc tạo máu từ máu cuống rốn (UC-HSC) có nhiều ưu điểm so với tế bào gốc tạo máu từ tủy xương hay máu ngoại vi. Đầu tiên, việc thu thập và xử lý máu cuống rốn rất dễ dàng và đơn giản. Quá trình thu thập máu cuống rốn chỉ diễn ra 3-5 phút sau khi em bé được sinh ra, việc thu thập này không gây đau đớn cho cả mẹ và bé. Quá trình xử lý thu hoạch HSC cũng rất nhanh, chỉ mất vài ngày đến vài tuần để xử lý và lưu trữ (12). Trong khi ngược lại, việc thu thập HSC từ máu ngoại vi và tủy xương cần gây mê và xâm lấn đối với người hiến tặng, thời gian xử lý cũng đến vài tuần đến vài tháng và chi phí cũng tốn kém hơn (11). Điều quan trọng hơn, lượng UC-HSC trong 1 đơn vị thể tích máu cuống rốn nhiều hơn so với lượng tìm thấy trên tủy xương và máu ngoại vi (13). Trong việc cấy ghép điều trị bệnh, UC-HSC có thể là nguồn nhanh chóng có thể tiếp cận và sử dụng cho những bệnh cấp tính và mãn tính do các việc lưu trữ tế bào gốc máu cuống rốn đã trở nên phổ biến trên toàn thế giới. Ước tính đã có 450.000 mẫu đã được lưu trữ ở hơn 50 ngân hàng mô trên thế giới (14). Thêm vào đó, ghép UC-HSC có thể được dùng kể cả khi có sự không hòa hợp miễn dịch bạch cầu (HLA), cũng như việc gây ít hiệu ứng thải ghép chống vật chủ (GvHD) ở người nhận (11). Các ưu điểm trên cũng có thể là lý do mà đến hiện nay, đã có hơn 20.000 mẫu UC-HSC được ghép để điều trị bệnh kể từ ca đầu tiên năm 1988 (14,11).
ỨNG DỤNG CỦA TẾ BÀO GỐC MÁU CUỐNG RỐN TRONG ĐIỀU TRỊ HỘI CHỨNG OMENN
Tế bào gốc tạo máu (HSC) là các tế bào nguyên thủy, chưa trưởng thành có khả năng phát triển thành tất cả các loại tế bào máu, bao gồm cả tế bào dòng tủy và dòng bạch huyết (15) (hình 2). Khi trẻ sơ sinh được chuẩn đó hội chứng Omeen, hệ miễn dịch của người bệnh sẽ hoàn toàn không có tác dụng do sự suy giảm số lượng và chức năng tế bào lympho T. Do đó, nếu không được ghép tế bào gốc tạo máu giúp phục hồi nguồn tế bào lympho T giúp phục hồi hệ miễn dịch, trẻ sẽ bị tử vong rất sớm trong gia đoạn đầu đời vì nhiễm trùng (7). Sử dụng tế bào gốc tạo máu từ máu cuống rốn để điều trị hội chứng Omenn đã được thực hiện từ rất sớm.

Hình 2: Tế bào gốc tạo máu và khả năng phát triển thành các tế bào thuộc hệ tạo máu của nó
Năm 1999, Bệnh viện Infantil Nino Ä Jesus, Tây Ban Nha đã điều trị thành công cho bệnh nhi 19 tháng tuổi mắc hội chứng Omenn bằng tế bào gốc tạo máu từ nguồn máu cuống rốn của một người không có quan hệ huyết thống. Bệnh nhân có biểu hiện ban đầu như ban đỏ toàn thân, tiết dịch bỏng vảy ở da ở tháng đầu tiên, các tháng sau đó bệnh nhân bị nhiễm trùng liên tục liên quan đến nấm, gan to, lách to. Các xét nghiệm sau đó cho thấy bệnh nhân bị hội chứng Omenn. Do không có sự tương thích sinh học với người hiến là họ hàng, một đơn vị máu cuống rốn được chuyển từ Ngân hàng Máu New York. Người hiến chỉ có 01 HLA-Ag không khớp trên HLA-B. Liều ghép UC-HSC có chứa MNC: (0.38×106 tế bào/cân nặng) và CD34+: 0.73×106 (tế bào/cân nặng) theo truyền tĩnh mạch. Bệnh nhân được chăm sóc trong môi trường vô trùng, sử dụng thuốc kháng thải ghép và kháng sinh dự phòng. Tình trạng bệnh nhân được cải thiện sau ghép khi có chỉ số về lượng tế bào T, B tăng sau 13-17 ngày sau ghép. Bệnh nhân được xuất viện sau 34 ngày, các kết quả đánh giá sau 240 ngày ghép vẫn ổn định và giải quyết hoàn toàn vấn đề về lâm sàng và phục hồi miễn dịch (16).
Năm 2005, bệnh viện Đại học Y và Nha khoa Tokyo Nhật Bản đã có công bố về trường hợp ghép thành công UC-HSC cho bệnh nhi 7 tháng tuổi. Bệnh nhi có các biểu hiện của hội chứng Omenn lúc 3 tháng tuổi, phân tích gen cho thấy đột biến gen RAG1. Sau 4 tháng nhập viện, bệnh nhi được ghép tế bào tạo máu từ nguồn máu cuống rốn do không có người hiến tặng phù hợp. Liều lượng tổng MNC ghép là 5,29 x107 (tế bào/cân nặng). Tuy nhiên, phác đồ có bổ sung việc truyền tế bào lympho T của mẫu máu cuống hiến đã được nuôi cấy mở rộng từ ngày thứ 41 sau khi truyền và kéo dài trong vòng 2 tuần ở liều lượng 2,4×108 tế bào/lần truyền. Việc bổ sung này nhằm khắc phục nguy cơ thải ghép. Kết quả ghép sau 1 tháng cho thấy lượng tế bào lympho đã quay trở lại, tuy nhiên, phân tích tế bào dòng chảy cho thấy lượng tế bào lympho từ người hiến chỉ chiếm 49% lượng tế bào lympho tổng số. Lượng tế bào T có nguồn gốc từ người hiến đã tăng lên 54% sau ghép nhờ có việc truyền bổ sung tế bào T-CD4 và đạt 100% từ ngày thứ 69 đến ngày cuối đánh giá là ngày thứ 152 sau ghép. Kết quả điều trị này cho thấy việc bổ sung T-CD4 đã góp phần đạt được nhanh chóng khả năng mọc mảnh ghép, vì đã quan sát thấy các bạch cầu chiếm ưu thế có nguồn gốc từ người hiến tặng nhanh chóng sau khi bắt đầu sử dụng T-CD4- trong khi bệnh nhân vẫn còn về thuốc ức chế miễn dịch (17). Năm 2009, bệnh viện đại học Heinrich-Heine Đức đã công bố ghép thành công HSC từ nguồn máu cuống rốn hiến tặng cho bệnh nhi 6 tháng chuẩn đoán mắc hội chứng Omenn thể đột biến gen RAG1. Người hiến có độ phù hợp HLA chỉ đạt 8/10 với bệnh nhi. Kết quả ghép C-HSC với liều lượng MNC là 1,8 x108/cân nặng. Sau 6 ngày ghép, bệnh nhi tăng bạch cầu tổng số lên 3,8×109 tế bào/uL. Sau 31 ngày, các xét nghiệm cho thấy tế bào lympho T đã được thay thế hoàn toàn bằng tế bào lympho T có nguồn gốc từ người hiến. Kết quả đánh giá sau 1,5 năm sau cho thấy lượng tế bào Lympho ổn định và nằm trong khoảng bình thường theo lứa tuổi (18).
Theo đánh cơ sở dữ liệu của hai tổ chức SCETIDE (Stem Cell Transplant in Primary Immune Deficiency in Europe) và Eurocord từ năm 1999 đến năm 205 có 38 trường hợp bệnh nhi mắc hội chứng Omenn được ghép tế bào gốc tạo máu từ người hiến tặng có quan hệ họ hàng (n =23) hoặc từ nguồn máu cuống rốn không liên quan (n=13) được thực hiện tại 12 trung tâm và 50 bệnh viện tại châu Âu. Độ tuổi nhận trị liệu là khoảng 6,4 tháng tuổi. Tỉ lệ ghép có HLA phù hợp 100% hoặc có 1 sự không phù hợp là 67%, còn lại 33% là có từ 2-3 sự không phù hợp HLA. Thời gian theo dõi sau ghép trung bình là 59 tháng, có 83% các bệnh nhân được ghép thành công, tỉ lệ sống sót sau 5 năm sau ghép là 58% (19).
Điều này cho thấy tiềm năng và tầm quan trọng của máu cuống rốn trong điều trị hội chứng Omenn kể cả trường hợp sử dụng máu cuống rốn của anh chị em hoặc của người hiến tặng. Việc lưu trữ tế bào gốc máu cuống rốn hiện nay như một bảo hiểm sinh học để điều trị cho các bệnh lý huyết học, nhát là việc lưu trữ có thể thực hiện một các dễ dàng thông qua các ngân hàng sinh học có các hệ thống lưu trữ lạnh bằng nito lỏng có thể bảo quản lên đến hàng chục năm mà vẫn đảm bảo chất lượng để tiến hành ghép.
TÀI LIỆU THAM KHẢO
- Benhsaien, I., Essadssi, S., Elkhattabi, L., Bakhchane, A., Abdelghaffar, H., Bousfiha, A. A., Badou, A., & Barakat, A. (2021). Omenn syndrome caused by a novel homozygous mutation in recombination activating gene 1. Immunobiology, 226(3), 152090. https://doi.org/10.1016/j.imbio.2021.152090.
- Chia-Chi Hsu, Julia Yu-Yun Lee, Sheau-Chiou Chao,Omenn syndrome: a case report and review of literature,Dermatologica Sinica,Volume 29, Issue 2,2011,Pages 50-54,ISSN 1027-8117,https://doi.org/10.1016/j.dsi.2011.05.002.
- Aleman, K., Noordzij, J. G., de Groot, R., van Dongen, J. J., & Hartwig, N. G. (2001). Reviewing Omenn syndrome. European journal of pediatrics, 160, 718-725.
- Wadbudhe, A. M., Meshram, R. J., & Tidke, S. C. (2023). Severe Combined Immunodeficiency (SCID) and Its New Treatment Modalities. Cureus, 15(10). Wadbudhe, A. M., Meshram, R. J., & Tidke, S. C. (2023). Severe Combined Immunodeficiency (SCID) and Its New Treatment Modalities. Cureus, 15(10).
- Aluri, J., Desai, M., Gupta, M., Dalvi, A., Terance, A., Rosenzweig, S. D., … & Madkaikar, M. (2019). Clinical, immunological, and molecular findings in 57 patients with severe combined immunodeficiency (SCID) from India. Frontiers in immunology, 10, 23.
- Shearer, W. T., Dunn, E., Notarangelo, L. D., Dvorak, C. C., Puck, J. M., Logan, B. R., … & Cowan, M. J. (2014). Establishing diagnostic criteria for severe combined immunodeficiency disease (SCID), leaky SCID, and Omenn syndrome: the Primary Immune Deficiency Treatment Consortium experience. Journal of allergy and clinical immunology, 133(4), 1092-1098.
- Hsu, C. C., Lee, J. Y. Y., & Chao, S. C. (2011). Omenn syndrome: a case report and review of literature. Dermatologica Sinica, 29(2), 50-54.
- Bosticardo, M., Pala, F., & Notarangelo, L. D. (2021). RAG deficiencies: recent advances in disease pathogenesis and novel therapeutic approaches. European journal of immunology, 51(5), 1028-1038.
- Dvorak, C. C., Haddad, E., Heimall, J., Dunn, E., Cowan, M. J., Pai, S. Y., … & Puck, J. M. (2023). The diagnosis of severe combined immunodeficiency: implementation of the PIDTC 2022 definitions. Journal of Allergy and Clinical Immunology, 151(2), 547-555.
- Aleman, K., Noordzij, J. G., de Groot, R., van Dongen, J. J., & Hartwig, N. G. (2001). Reviewing Omenn syndrome. European journal of pediatrics, 160, 718-725.
- Alatyyat, S. M., Alasmari, H. M., Aleid, O. A., Abdel-Maksoud, M. S., & Elsherbiny, N. (2020). Umbilical cord stem cells: Background, processing and applications. Tissue and Cell, 65, 101351.
- Broxmeyer, H. E., & Smith, F. O. (2009). Cord blood hematopoietic cell transplantation. Thomas’ Hematopoietic Cell Transplantation: Stem Cell Transplantation, 559-576.
- Jahan, S., Kaushal, R., Pasha, R., & Pineault, N. (2021). Current and future perspectives for the cryopreservation of cord blood stem cells. Transfusion Medicine Reviews, 35(2), 95-102.
- Broxmeyer, H. E. (2021). Cord blood hematopoietic stem cell transplantation. International Journal of Biomedical and Health Sciences, 9(2).
- Lee, J. Y., & Hong, S. H. (2020). Hematopoietic stem cells and their roles in tissue regeneration. International journal of stem cells, 13(1), 1-12.
- Benito, A., Diaz, M. A., Alonso, F., Fontan, G., & Madero, L. (1999). Successful unrelated umbilical cord blood transplantation in a child with Omenn’s syndrome. Pediatric hematology and oncology, 16(4), 361-366.
- Tomizawa, D., Aoki, Y., Nagasawa, M., Morio, T., Kajiwara, M., Sekine, T., … & Mizutani, S. (2005). Novel adopted immunotherapy for mixed chimerism after unrelated cord blood transplantation in Omenn syndrome. European journal of haematology, 75(5), 441-444.
- Schönberger, S., Ott, H., Gudowius, S., Wüller, S., Baron, J. M., Merk, H. F., … & Niehues, T. (2009). Saving the red baby: successful allogeneic cord blood transplantation in Omenn syndrome. Clinical Immunology, 130(3), 259-263.
- Fernandes, J. F., Rocha, V., Labopin, M., Neven, B., Gennery, A., Friedrich, W., … & Cavazzana-Calvo, M. (2009). Comparison of Outcomes of Mismatched Related Stem Cell and Unrelated Cord Blood Transplants in Children with Severe T-Cell Deficiencies. Blood, 114(22), 664.
