Tế bào gốc trung mô trong điều trị và phục hồi sau đột quỵ
Đột quỵ hay còn gọi là tai biến mạch máu não là tình trạng não bộ bị tổn thương do thiếu máu cung cấp lên não. Các cục máu đông hình thành trong não và làm gián đoạn lưu lượng máu lên não, làm tắc nghẽn động mạch và khiến mạch máu bị vỡ dẫn đến chảy máu não. Việc vỡ động mạch dẫn đến việc không đủ hoặc không có máu cung cấp oxi và chất dinh dưỡng cho các tế bào thần kinh não bộ dẫn đến chúng bị chết đột ngột nếu không được cấp cứu ngay lập tức. Chính vì vậy, bệnh nhân sau đột quỵ thường để lại tổn thương nặng nề về thần kinh như liệt một phần cơ thể, mất ngôn ngữ, rối loạn hành vi, cảm xúc (1).
Tải file PDF tại đây: Tế bào gốc trung mô trong điều trị và phục hồi sau đột quỵ – PDF
Đột quỵ là nguyên nhân gây tử vong đứng hàng thứ hai trên toàn cầu, mỗi năm chúng ảnh hưởng đến khoảng 12,2 triệu người và 6,5 triệu người tử vong mỗi năm (2). Khoảng 87% các ca đột quỵ do thiếu máu cục bộ. Tỉ lệ mắc đột quỵ tăng theo số tuổi, tỉ lệ này tăng gấp đôi đối với người trên 55 tuổi, tuy nhiên, độ tuổi mắc đột quỵ từ 20-54 đã tăng từ 12,9% lên 28,6% từ năm 1990 đến 2016 (3). Bệnh nhân đột quỵ thường có tổn thương về thần kinh não bộ, do đó các phương pháp giúp phục hồi tổn thương về thần kinh của bệnh nhân đột quỵ là hướng nghiên cứu chủ yếu, trong đó, sử dụng tế bào gốc đang là xu hướng mới do các đặc tính quan trọng của tế bào gốc trong việc tái tạo và sửa chữa. Trong đó, liệu pháp sử dụng tế bào gốc trung mô (mesenchymal stem cells, MSCs) để điều trị đang dẫn đầu các liệu pháp tế bào gốc trong điều trị bệnh nhân đột quỵ (3).
Đột quỵ và đặc điểm của đột quỵ
Lưu lượng máu cung cấp lên não được cung cấp bởi hai nguồn: Các động mạch cảnh trong phát sinh tại cổ và các động mạch đốt sống (vòng tròn willis). Các động mạch cảnh trong phân nhánh để tạo thành hai động mạch não lớn là động mạch não trước và não giữa. Các động mạch đốt sống phải và trái gặp nhau ở cầu não trên bề mặt bụng của thân não để tạo thành động mạch nền giữa (4). Các tế bào thần kinh khá nhạy cảm với tình trạng thiếu oxy và glucose, do vậy, khi nguồn cung cấp máu bị tổn thương, không đủ máu cung cấp thì các tế bào thần kinh sẽ bị tổn thương tạm thời hoặc vĩnh viễn nếu không được đảo ngược nhanh chóng. Đột quỵ được chia thành hai loại: đột quỵ do thiếu máu cục bộ chiếm 80% nguyên nhân do huyết khối hoặc cúc máu đông gây tắc mạch và 20% là đột quỵ do vỡ mạch (5,6). Các biến chứng đột quỵ thường liên quan đến tổn thương về thần kinh như rối loạn giấc ngủ, liệt một phần cơ thể hoặc toàn thân, mất tri giác các chức năng như đi bộ, nhìn, nhận, cảm nhận, nhớ, suy nghĩ có thể suy giảm (6).
Các chiến lược điều trị cho bệnh nhân đột quỵ hiện nay bao gồm sử dụng các thuốc giúp bảo vệ và giảm tổn thương cho hệ thống tế bào thần kinh khi hiện tượng thiếu máu xảy ra như: thuốc Clomethiazole (giảm độc tố do glutamate gây ra), Mexiletine, các thuốc làm tan huyết khối tĩnh mạch giúp cải thiện việc vận chuyển máu, tuy nhiên, các phương pháp này chỉ hiệu quả cho các trường hợp được can thiệp dưới 9 hoặc dưới 24 tiếng sau đột quỵ (7,8). Hiệu quả của các phương pháp hiện tại đối với phục hồi chức năng sau đột quỵ là khá hạn chế. Kết quả là, phần lớn những người sống sót sau đột quỵ bị tổn thương thần kinh suốt đời do sự tái tạo cấu trúc, chức năng của mô não bị tổn thương là không đầy đủ (9). Tìm ra những cách tiếp cận mới để phát triển một liệu pháp điều trị đột quỵ hiệu quả ở cả giai đoạn cấp tính và sau đột quỵ của bệnh nhân là một hướng nghiên cứu cần thiết và cấp thiết hiện nay. Liệu pháp sử dụng tế bào gốc là một hướng mới đầy hứa hẹn, an toàn và hiệu quả cho bệnh nhân đột quỵ.
Vai trò và cơ chế của tế bào gốc trung mô trong điều trị đột quỵ
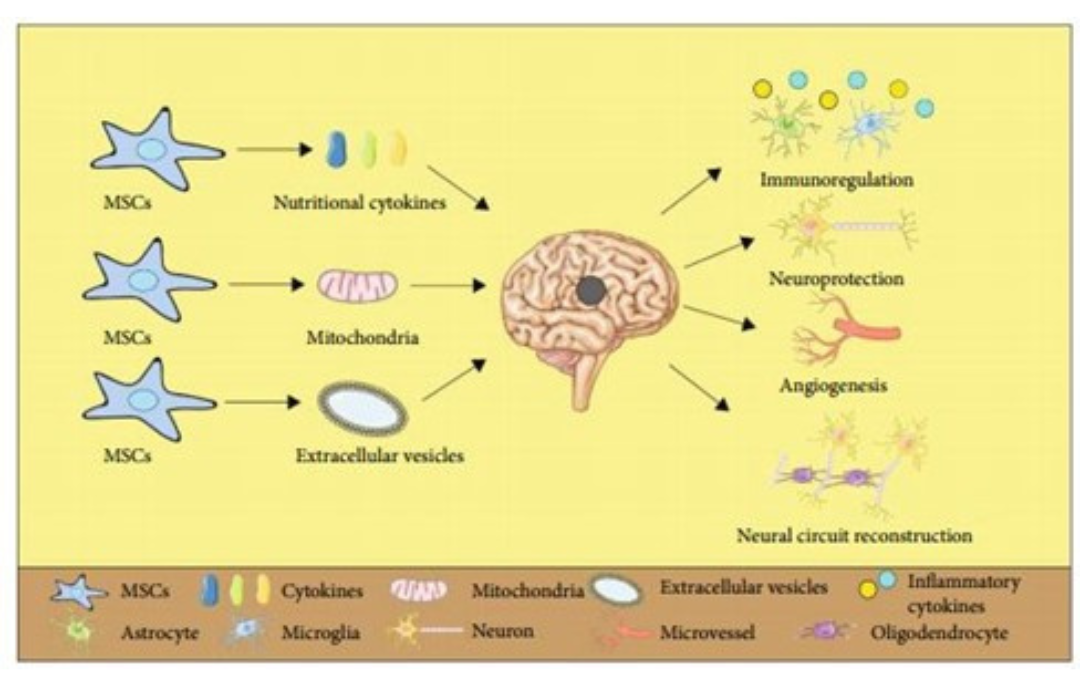
Tế bào gốc trung mô (mesenchymal stem cells, MSCs), hiệp hội trị liệu tế bào ISCT đã định nghĩa bộ tiêu chuẩn để xác định MSC của con người cho cả nghiên cứu khoa học và ứng dụng lâm sàng đó là: phải có khả năng bám dính với bề mặt nhựa của chai nuôi cấy tế bào tiêu chuẩn (loại tế bào bám dính), 95% tế bào MCS phải biểu hiện đầy đủ các chỉ thị bề mặt (Cluster of differentiation, CD) CD73, CD90 và CD 10 và không biểu hiện các chỉ thị bề mặt CD11b, CD14, CD19, CD34, CD45, CD79 α, HLA-DR khi thực hiện bằng kỹ thuật đếm tế bào dòng chảy (flow cytometry) và có khả năng biệt hóa thành nguyên bào xương, sụn và tế bào mỡ trong điều kiện thí nghiệm (10). MSCs có khả năng tăng sinh vô hạn trong điều kiện nuôi cấy và được đánh giá mức độ biến đổi di truyền để tránh dòng tế bào có bất thường về nhiễm sắc thể. MSCs thường thể hiện tính dung nạp miễn dịch tốt do chỉ biểu hiện mức thấp các phân tử hòa hợp miễn dịch lớp I (MCHI) và không hoặc ít biểu hiện MHCII do đó không gây kích thích các tế bào T và NK, do đó, việc ghép tế bào MSCs đồng loài an toàn và tránh tác dụng phụ không mong muốn (11). Cơ chế MSCs trong việc điều trị cho bệnh nhân đột quỵ đã và đang được nghiên cứu, tuy vẫn chưa được làm sáng tỏ hoàn toàn, nhưng một số cơ chế giúp MSCs cải thiện tình trạng bệnh nhân đột quỵ được nêu ra (Hình 1).
Hình 1: Cơ chế của MSC trong điều trị đột quỵ
- MSCs có khả năng điều hòa phản ứng miễn dịch và phản ứng viêm. Sau khi bị đột quỵ, các tế bào thần kinh và mô tế bào não bị tổn thương, giải phóng các tác nhân oxi hóa và cytokine tiền viêm kích thích các tế bào gây viêm, thu hút lượng lớn yếu tố gây viêm dẫn đến hàng rào máu não bị phá hủy, các tế bào miễn dịch xâm nhập liên tục có thể dẫn đến hoại tử tế bào thần kinh, phù não và tăng tổn thương não thứ phát ở bệnh nhân đột quỵ (12). MSCs đã được nghiên cứu có khả năng tiết ra các cytokine chống viêm như TGF-β, ngăn chặn sự di chuyển tế bào miễn dịch đến vùng thiếu máu não (13). Nghiên cứu của Huang và cộng sự đã kết hợp MSCs với các tế bào thần kinh thiếu oxy và glucose đã cho thấy tế bào MSCs có khả năng chống viêm thông qua tiết IL-6 và giảm biểu hiện của các cytokine tiền viêm như TNF-α (14).
- MSCs có khả năng bảo vệ tế bào thần kinh khi đột quỵ. Việc thiếu máu cục bộ gây đột quỵ thường gây ra vùng lõi thiếu máu cục bộ trung tâm và bán cầu thiếu máu xung quanh. Vì vậy, việc bảo vệ các tế bào thần kinh chưa chết xung quanh vùng lõi là điều quan trọng trong điều trị đột quỵ (15). MSCs thể hiện khả năng giúp giảm việc chết theo chu trình của các tế bào thần kinh. Nghiên cứu của Zhu và cộng sự thực hiện ghép tế bào MSCs cho thỏ bị đột quỵ do thiếu máu cục bộ đã cho kết quả nhóm thỏ được điều trị MSCs có tăng biểu hiện protein Bcl-2 là một yếu tố ngăn chặn việc chết theo chương trình, đồng thời, giảm sự biểu hiện protein p53, một loại protein cảm ứng liên quan đến chết theo chu trình của tế bào thần kinh. MSCs có thể giải phóng các yếu tố dinh dưỡng thần kinh như yếu tố tăng trưởng nguyên bào sợi cơ bản (bFGF), yếu tố dinh dưỡng thần kinh có nguồn gốc từ não (BDNF), yếu tố tăng trưởng dây thần kinh (NGF) (16-18).
- MSCs có khả năng hình thành mạch. Sau đột quỵ, các mạch máu não bị phá hủy dẫn đến hàng rào máu não bị tổn thương. MSCs có khả năng cách tiết ra các chất như yếu tố tăng trưởng nội mô mạch máu (VEGF) giúp thúc đẩy sự hình thành mạch giai đoạn chưa trưởng thành và angiopoietin-1 (Ang-1) tham gia vào quá trình trưởng thành và ổn định của mạch (19,20). Việc các tế bào MSCs có thể biệt hóa thành tế bào thần kinh và tế bào thần kinh đệm là một trong những mục tiêu của việc truyền MSCs trong điều trị đột quỵ. Tuy nhiên, các thử nghiệm truyền MSCs vào vỏ não xung quanh vùng nhồi máu cho thấy các tế bào MSCs có dấu hiện của tế bào thần kinh biệt hóa chưa trưởng thành, tuy nhiên chúng thiếu các kênh ion cần thiết để tạo ra điện thế hoạt động (21). Vì vậy, việc MSCs biệt hóa thành tế bào thần kinh không phải là cơ chế giúp điều trị đột quỵ mà chúng có khả năng thúc đẩy và di cư và sống sót của các nguyên bào thần kinh đến vùng xung quanh của lõi thiếu máu cục bộ (22). Ngoài ra, các nghiên cứu khác chỉ ra MSC có thể thúc đẩy việc tổ chức lại các kết nối thần kinh bằng cách ức chế các protein gây ức chế sợi trục thần kinh và tăng biểu hiện synaptophysin (23). Ngoài ra, việc truyền MSCs-ti thể và EV có nguồn gốc từ MSC là các thành phần tế bào hình cầu được tiết ra từ MSC cũng mang lại hiệu quả trong điều trị đột quỵ.
Các thử nghiệm lâm sàng sử dụng MSCs trong điều trị đột quỵ
Có nhiều nghiên cứu tiền lâm sàng về việc sử dụng tế bào gốc MSC điều trị cho đột quỵ và các thử nghiệm trên mô hình động vật đều cho kết quả khả quan, vì vậy, việc ứng dụng tế bào gốc MSCs để điều trị trên bệnh nhân cũng đã được thực hiện và đánh giá hiệu quả. Nghiên cứu của Bang và cộng sự nghiên cứu lâm sàng trên 30 bệnh nhân bị đột quỵ do thiếu máu não cục bộ, trong đó chỉ 5 người được truyền MSCs tự thân với liều lượng 1×108 tế bào đường tiêm tĩnh mạch sau 5-7 tuần, nhóm còn lại không được truyền MSCs. Trong thời gian quan sát 1 năm, không có tác dụng phụ nào xuất hiện trên các bệnh nhân trên và các hình ảnh thay đổi khiếm khuyết thần kinh, cải thiện chức năng ở các bệnh nhân mỗi nhóm được ghi nhận liên tục.
Kết quả cho thấy ở nhóm bệnh nhân sử dụng MSCs, các chỉ số theo dõi như Barthel (đánh giá hoạt động hàng ngày), Thang điểm mRS (Modified Rankin Scale: đánh giá khả năng tự chăm sóc bản thân của bệnh nhân đột quỵ) đều có sự cải thiện nhất quán sau 3, 6 và 12 tháng quan sát, không có tác dụng phụ nào được quan sát thây hoặc thay đổi bất thường nào trong đánh giá tế bào và huyết học (24).
Một điều trị lâm sàng trên nhóm 85 bệnh nhân, độ tuổi từ 30-75 tuổi bị đột quỵ do thiếu máu cục bộ nặng đã được Lee và cộng sự thực hiện trong thời gian 5 năm, các bệnh nhân phân bố ngỗng nhiên vào hai nhóm: điều trị bằng MSCs tự thân liều lượng 1×108 tế bào/bệnh nhân qua đường tĩnh mạch và không sử dụng MSCs (nhóm đối chứng). Kết quả đánh giá cho thấy số lượng bệnh nhân có thang điểm mRS từ 0-3 (0-hoàn toàn không có triệu chứng, 3-di chứng dạng vừa có thể tự đi lại) trên các bệnh nhân điều trị MSCs tăng lên rõ rệt trong khi nhóm đối chứng thì thang điểm giảm xuống. Không có tác dụng phụ nghiêm trọng nào ở cả hai nhóm nghiên cứu (25).
Nghiên cứu thử nghiệm lâm sàng giai đoạn I/II của Levy và cộng sự thực hiện trên bệnh nhân đột quỵ mãn tính và bị khuyết tật đáng kể do đột quỵ, các bệnh nhân giai đoạn I được truyền MSCs đồng loài đường tĩnh mạch với liều lượng từ 0,5, 1 và 1,5×106 tế bào/kg cân nặng. Giai đoạn 2 đường truyền 1,5×106 tế bào/kg cân nặng. Kết quả cả hai giai đoạn cho thấy, chỉ số Barthel tăng 6,8 ± 11 đến 10,8 ± 15,5 sau 12 tháng điều trị. Tỷ lệ bệnh nhân có mức Barthel >95 điểm (mức độc lập hoàn toàn) tăng từ 11,4% ban đầu lên 27,6% sau 8 tháng và 33,5% sau 12 tháng. Kết quả trên cho thấy việc truyền tĩnh mạch và sử dụng MSCs đồng loài ở bệnh nhân đột quỵ do thiếu máu cục bộ là an toàn và cải thiện hành vi hoạt động thường ngày (26). Một thử nghiệm lâm sàng giai đoạn II cũng đang được tiến bởi hành Deng và cộng sự nhằm đánh giá an toàn và hiệu quả của việc truyền tế bào MSC từ tủy xương (BM-MSC) đồng loài lần đầu cho bệnh nhân bị đột quỵ do thiếu máu cục bộ.
Nhóm 59 bệnh nhân được truyền BM-MSC bốn lần/tuần liều 1×106 tế bào/kg cân nặng được thực hiện qua đường tĩnh mạch. Thang điểm mRS dùng đánh giá hiệu quả điều trị và không quan sát các tác dụng phụ sau 90 ngày. Thử nghiệm vân đang được tiến hành và chưa có báo cáo kết quả cụ thể (27). Ngoài ra, nhóm nghiên cứu Steinberg và cộng sự đã cấy tế bào SB623, một dòng tế bào BM-MSC được truyền gen Notch-1 vào não của 18 bệnh nhân bị đột quỵ mãn tính. Kết quả cho thấy những cải thiện đáng kể về điểm số Thang điểm Đột quỵ Châu Âu (ESS), điểm NIHSS, tổng điểm Fugl-Meyer (FM) và điểm số Thang điểm Bài tập FM sau 24 tháng điều trị (28).
Việc ứng dụng tế bào MSCs trong điều trị mang lại hy vọng điều trị cho bệnh nhân đột quỵ về cải thiện và phục hồi các tổn thương sau đột quỵ. Các nghiên cứu sâu hơn về cơ chế và vai trò của tế bào MSCs trong phục hồi tổn thương do đột quỵ gây ra giúp cho việc hiểu sâu và có chiến lược điều trị phù hợp cho các bệnh nhân cũng như là nền tảng vững chắc cho các chuyển đổi lâm sàng của liệu pháp sử dụng tế bào MSC.
TÀI LIỆU THAM KHẢO
1.Kuriakose, D., & Xiao, Z. (2020). Pathophysiology and treatment of stroke: present status and future perspectives. International journal of molecular sciences, 21(20), 7609.
2.Feigin, V. L., Brainin, M., Norrving, B., Martins, S., Sacco, R. L., Hacke, W., … & Lindsay, P. (2022). World Stroke Organization (WSO): global stroke fact sheet 2022. International Journal of Stroke, 17(1), 18-29.
3.Collaborators, G. B. D. S. (2019). Global, regional, and national burden of stroke, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Neurol, 18(5), 439-458.
4.Purves D, Augustine GJ, Fitzpatrick D, et al., editors. Neuroscience. 2nd edition. Sunderland (MA): Sinauer Associates; 2001. The Blood Supply of the Brain and Spinal Cord. Available from: https://www.ncbi.nlm.nih.gov/books/NBK11042/
5.Musuka, T. D., Wilton, S. B., Traboulsi, M., & Hill, M. D. (2015). Diagnosis and management of acute ischemic stroke: speed is critical. Cmaj, 187(12), 887-893.
6.Powers, W. J., Rabinstein, A. A., Ackerson, T., Adeoye, O. M., Bambakidis, N. C., Becker, K., … & American Heart Association Stroke Council. (2019). Guidelines for the early management of patients with acute ischemic stroke: 2019 update to the 2018 guidelines for the early management of acute ischemic stroke: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke, 50(12), e344-e418.
7.Campbell, B. C., Ma, H., Ringleb, P. A., Parsons, M. W., Churilov, L., Bendszus, M., … & Hsu, J. P. (2019). Extending thrombolysis to 4· 5–9 h and wake-up stroke using perfusion imaging: a systematic review and meta-analysis of individual patient data. The Lancet, 394(10193), 139-147.
8.Nogueira, R. G., Jadhav, A. P., Haussen, D. C., Bonafe, A., Budzik, R. F., Bhuva, P., … & Jovin, T. G. (2018). Thrombectomy 6 to 24 hours after stroke with a mismatch between deficit and infarct. New England Journal of Medicine, 378(1), 11-21.
9.Grefkes, C., & Fink, G. R. (2020). Recovery from stroke: current concepts and future perspectives. Neurological research and practice, 2(1), 1-10.
10.Dominici, M. L. B. K., Le Blanc, K., Mueller, I., Slaper-Cortenbach, I., Marini, F. C., Krause, D. S., … & Horwitz, E. M. (2006). Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy, 8(4), 315-317.
11.Chen, C. (2014). From mesenchymal stem cell therapy to discovery of drug therapy for systemic sclerosis (Doctoral dissertation, University of Southern California).
12.Shichita, T., Ito, M., & Yoshimura, A. (2014). Post-ischemic inflammation regulates neural damage and protection. Frontiers in cellular neuroscience, 8, 319.
13.Yoo, S. W., Chang, D. Y., Lee, H. S., Kim, G. H., Park, J. S., Ryu, B. Y., … & Suh-Kim, H. (2013). Immune following suppression mesenchymal stem cell transplantation in the ischemic brain is mediated by TGF-β. Neurobiology of disease, 58, 249-257.
14.Huang, P., Gebhart, N., Richelson, E., Brott, T. G., Meschia, J. F., & Zubair, A. C. (2014). Mechanism of mesenchymal stem cell–induced neuron recovery and anti-inflammation. Cytotherapy, 16(10), 1336-1344.
15.Dabrowska, S., Andrzejewska, A., Lukomska, B., & Janowski, M. (2019). Neuroinflammation as a target for treatment of stroke using mesenchymal stem cells and extracellular vesicles. Journal of Neuroinflammation, 16(1), 1-17.
16.Zhu, Y., Guan, Y. M., Huang, H. L., & Wang, Q. S. (2014). Human umbilical cord blood mesenchymal stem cell transplantation suppresses inflammatory responses and neuronal apoptosis during early stage of focal cerebral ischemia in rabbits. Acta Pharmacologica Sinica, 35(5), 585-591.
17.Nomura, T., Honmou, O., Harada, K., Houkin, K., Hamada, H., & Kocsis, J. D. (2005). I.V. infusion of brain-derived neurotrophic factor gene-modified human mesenchymal stem cells protects against injury in a cerebral ischemia model in adult rat. Neuroscience, 136(1), 161–169.
18.Chen, J., Li, Y., Katakowski, M., Chen, X., Wang, L., Lu, D., … & Chopp, M. (2003). Intravenous bone marrow stromal cell therapy reduces apoptosis and promotes endogenous cell proliferation after stroke in female rat. Journal of neuroscience research, 73(6), 778-786.
19.Zhang, Y., Ma, L., Su, Y., Su, L., Lan, X., Wu, D., … & Ji, X. (2019). Hypoxia conditioning enhances neuroprotective effects of aged human bone marrow mesenchymal stem cell-derived conditioned medium against cerebral ischemia in vitro. Brain Research, 1725, 146432.
20.Toyama, K., Honmou, O., Harada, K., Suzuki, J., Houkin, K., Hamada, H., & Kocsis, J. D. (2009). Therapeutic benefits of angiogenetic gene-modified human mesenchymal stem cells after cerebral ischemia. Experimental neurology, 216(1), 47–55.
21.Zhao, L. R., Duan, W. M., Reyes, M., Keene, C. D., Verfaillie, C. M., & Low, W. C. (2002). Human bone marrow stem cells exhibit neural phenotypes and ameliorate neurological deficits after grafting into the ischemic brain of rats. Experimental neurology, 174(1), 11-20.
22.Song, M., Mohamad, O., Gu, X., Wei, L., & Yu, S. P. (2013). Restoration of intracortical and thalamocortical circuits after transplantation of bone marrow mesenchymal stem cells into the ischemic brain of mice. Cell transplantation, 22(11), 2001-2015.
23.Shen, L. H., Li, Y., Chen, J., Cui, Y., Zhang, C., Kapke, A., … & Chopp, M. (2007). One-year follow-up after bone marrow stromal cell treatment in middle-aged female rats with stroke. Stroke, 38(7), 2150-2156.
24.Bang, O. Y., Lee, J. S., Lee, P. H., & Lee, G. (2005). Autologous mesenchymal stem cell transplantation in stroke patients. Annals of Neurology: Official Journal of the American Neurological Association and the Child Neurology Society, 57(6), 874-882.
25.Lee, J. S., Hong, J. M., Moon, G. J., Lee, P. H., Ahn, Y. H., & Bang, O. Y. (2010). A long-term follow-up study of intravenous autologous mesenchymal stem cell transplantation in patients with ischemic stroke. Stem cells, 28(6), 1099-1106.
26.Levy, M. L., Crawford, J. R., Dib, N., Verkh, L., Tankovich, N., & Cramer, S. C. (2019). Phase I/II study of safety and preliminary efficacy of intravenous allogeneic mesenchymal stem cells in chronic stroke. Stroke, 50(10), 2835-2841.
27.Deng, L., Peng, Q., Wang, H., Pan, J., Zhou, Y., Pan, K., … & Wang, Y. (2019). Intrathecal injection of allogenic bone marrow-derived mesenchymal stromal cells in treatment of patients with severe ischemic stroke: study protocol for a randomized controlled observer-blinded trial. Translational Stroke Research, 10, 170-177.
28.Steinberg, G. K., Kondziolka, D., Wechsler, L. R., Lunsford, L. D., Kim, A. S., Johnson, J. N., … & Schwartz, N. E. (2018). Two-year safety and clinical outcomes in chronic ischemic stroke patients after implantation of modified bone marrow–derived mesenchymal stem cells (SB623): a phase 1/2a study. Journal of Neurosurgery, 131(5), 1462-1472.