TẾ BÀO GỐC TRUNG MÔ TỪ TỦY RĂNG SỮA TRONG ĐIỀU TRỊ BỆNH LOÃNG XƯƠNG
Loãng xương là một bệnh lý về xương khớp, đặc trưng bởi khối lượng xương thấp do giảm mật độ chất khoáng trong xương, suy giảm mô xương và các vi cấu trúc trong xương dẫn đến xương yếu, gây chấn thương nhỏ hoặc gãy xương ở cột sống, cổ tay và khớp háng được thể hiện như trong hình 1 (1). Đây là bệnh nặng, mãn tính, tiến triển, thầm lặng về mặt lâm sàng và là bệnh phổ biến nhất trong số các bệnh về chuyển hóa xương. Loãng xương ảnh hưởng đến 44 triệu người Mỹ và hơn 200 triệu người trên toàn thế giới, cứ 3 phụ nữ hoặc 5 năm giới trên 50 tuổi thì có 1 người đã từng bị gãy xương do loãng xương trong đời (2,3). Theo thống kê của tổ chức loãng xương quốc tế IOF năm 2019, tại EU có 32 triệu ca chuẩn đoán mắc loãng xương, mức chi phí cho điều trị lên đến 56,9 tỉ USD. Loãng xương có thể chia làm hai phân nhóm lớn, đó là loãng xương nguyên phát: thường xảy ra ở thanh niên và trẻ em với các nguyên nhân không rõ ràng và loãng xương thứ phát hay loãng xương tiến triển: xảy ra ở cả nam và nữ giới thường có liên quan đến việc lão hóa. Loãng xương tiến triển chia thành hai loại là loãng xương loại I và loãng xương loại 2. Trong đó, loãng xương nguyên phát loại 1 chủ yếu ảnh hưởng đến phụ nữ sau mãn kinh từ 51 đến 75 tuổi đặc trưng bởi việc mất xương nhanh chóng. Loãng xương loại 2 hay còn gọi loãng xương do tuổi già ở người trên 75 tuổi và được đặc trưng bởi tình trạng xương xốp do lão hóa (3). Việc điều trị loãng xương hiện nay chủ yếu giúp người bệnh giảm nguy cơ gãy xương và cải thiện chất lượng cuộc sống. Phương pháp điều trị truyền thống là sử dụng các thuốc chống tiêu xương giúp ngăn chặn quá trình tiêu xương bằng cách ức chế các tế bào hủy xương, hầu hết các thuốc này thuộc nhóm: bisphosphonates, chất điều biến thụ thể estrogen chọn lọc (SERM), calcitonin và denosumab. Tuy nhiên, có nhiều nghiên cứu chỉ ra rằng việc sử dụng các thuốc này có thể là tăng nguy cơ xơ cứng xương và ung thư xương do tác dụng kích thích của chúng và chúng không được sử dụng để điều trị loãng xương lâu dài (4). Chính vì vậy, một phương pháp điều trị đang được thu hút gần đây để điều trị loãng xương đó là sử dụng liệu pháp tế bào gốc trung mô (Mesenchymal stem cell/MSC), do các tế bào gốc MSC có khả năng sửa chữa các mô tổn thương, khả năng biệt hóa hình thành xương và vai trò của nó trong cơ chế sinh bệnh loãng xương (5).
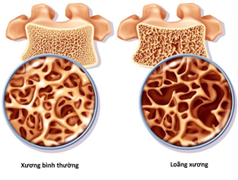
Xương bình thường và loãng xương
LOÃNG XƯƠNG VÀ VAI TRÒ CỦA TẾ BÀO GỐC MSC TỦY RĂNG SỬA
Mô xương là một mô liên kết năng động, xương cung cấp hỗ trợ cơ học cho chịu đựng tải trọng và vận động của cơ thể, cung cấp sự bảo vệ vật lý cho các cơ quan mềm bên trong, tạo thành một kho chứa các ion canxi và photphat không tĩnh và cung cấp một môi trường thích hợp cho sự phát triển của tủy xương và tế bào tạo máu (5). Trong xương có cấu trúc phân cấp với hai pha riêng biệt: Chất nền hữu cơ và chất nền vô cơ. Trong đó, chất nền hữu cơ bao gồm chủ yếu là collagen loại I, các sợi này liên kết bằng liên kết ngang ba chuỗi xoắn, cấu trúc này cung cấp cho xương khả năng chống lại lực kéo dọc và đàn hồi. Chất nền vô cơ chủ yếu là tinh thể hydroxyapatite và canxi photphat nằm trong khoảng trống tự do của nền hữu cơ. Ma trận này chịu trách nhiệm cho độ cứng của xương và khả năng chống chịu lại lực nén (6). Thể tích xương còn lại bao gồm các tế bào xương: Tế bào tiền thân xương và tế bào hủy xương. Tế bào tiền thân xương có gốc từ tế bào trung mô (MSC), sau đó chúng biệt hóa thành các nguyên xương bào và tế bào xương, quá trình biệt hóa của các tế bào này được bắt đầu khi chúng nhận được tín hiệu di chuyển đến một khu vực nhất định, tăng sinh và cuối cùng là biệt hóa. Nguyên bào xương là những tế bào lót trên bề mặt của xương và chịu trách nhiệm tổng hợp và bài tiết chất nền xương hữu cơ (7).
Loãng xương xảy ra khi có sự mất cân bằng giữa quá trình hình thành xương được thực hiện bởi nguyên xương bào và quá trình tiêu hủy xương thông qua quá trình hủy cốt bào (8). Có nhiều yếu tố ảnh hưởng đến sự mất cân bằng này như các yếu tố môi trường như thiếu canxi, thiếu vitamin D, lối sống ít vận động, ít tập thể dục, sử dụng các thuốc chống co giật, an thần, hút thuốc, rượu bia hoặc trọng lượng cơ thể lớn. Các yếu tố nội tiết như bất thường chu kì kinh nguyệt, mãn kinh do phẫu thuật hoặc thiết hụt estrogen. Ngoài ra, còn có yếu tố do di truyền, giới tính (8). Các dấu hiệu bệnh loãng xương có thể kể đến như: Đau thứ phát do gãy xương, biến dạng và nén nhiều đốt sống cổ gây gù hoặc ưỡn cổ, các xương sườn cuối cùng có thể tiếp xúc với mào chậu gây khó thở, chướng bụng. Gù lưng, xệ vai ở người lớn tuổi (3,8,9). Việc chuẩn đoán loãng xương chủ yếu dựa trên việc đánh giá khối lượng xương bằng phép đo mật độ xương (DEXA), giúp định lượng mô xương, chuẩn đoán và tiên đoán nguy cơ gãy xương. Phép đo hấp thụ tia X-kép giúp định mật độ khoáng xương dọc trục cột sống qua đó tính toán được hàm lượng canxi của xương (9,10).
Tế bào gốc MSC là tế bào gốc trưởng thành có mặt ở rất nhiều các cơ quan khác nhau như tủy xương (BM-MSC), mô mỡ (AD-MSC), tủy răng sữa (SHED) hoặc từ mô dây rốn (UC-MSC) (5). Là tế bào gốc có khả năng tăng sinh cao khi được nuôi cấy với chai nuôi cấy chuyên dụng và đặc biệt là vẫn giữ được các đặc tính gốc của chúng là: khả năng biệt hóa thành các nguyên xương bào, tế bào sụn và mỡ, ngoài ra, chúng còn đóng vai trò lớn trong việc điều hòa miễn dịch. Tế bào MSC đóng một vai trò quan trọng trong quá trình tiến triển của bệnh loãng xương. Sự hạn chế di chuyển MSC đến các vùng tủy xương bị tổn thương là một trong những nguyên nhân gây loãng xương. Nghiên cứu Haater và cộng sự nhận thấy MSC từ các bệnh nhân bị loãng xương di chuyển tăng vọt khi được kích thích bởi protein BMP-2, cũng như sự xâm lấn MSC vào trong xương cũng tăng lên (11). Rodriguez và cộng sự đã phát hiện ở những bệnh nhân bị loãng xương giai đoạn đầu, chất nền ngoại bào thiếu hụt collagen loại I tạo điều kiện thuận lợi cho sự biệt hóa MSC thành tế bào mỡ (12). Wang và cộng sự đã so sánh MSC của phụ nữ sau mãn kinh bị loãng xương với những người khỏe mạnh và xác nhận rằng: độ nhạy của MSC đối với sự biệt hóa chất tạo xương đã giảm ở những bệnh nhân bị loãng xương (13). Ở người lớn tuổi, lượng MSC thấp hơn nhiều so với người trẻ tuổi cũng là nguyên nhân gây loãng xương. Nghiên cứu của Stolzing và cộng sự đã phân lập và nuôi cấy MSC từ 57 người có độ tuổi từ 5-57 tuổi, kết quả cho thấy khả năng tăng sinh và hoạt động của tế bào MSC giảm đi theo tuổi tác, kèm theo đó là sự biệt hóa tạo xương yếu đi ngược lại biệt hóa thành tế mô mỡ lại tăng lên (14-16).
Sử dụng MSC để điều trị loãng xương là một hướng đi đầy hứa hẹn và tối ưu do vai trò của nó trong việc hình thành xương cũng như các ưu điểm của nó khi có thể phân lập và tăng sinh thông qua nuôi cấy. Tế bào MSC giúp hình thành xương thông qua hai cơ chế hoạt động. Một mặt, MSC nhắm vào vị trí bị tổn thương và biệt hóa thành các tế bào tạo xương, mặt khác, MSC tiết ra các yếu tố tăng trưởng đặc trưng, chẳng hạn như yếu tố tăng trưởng nội mô mạch máu (VEGF), yếu tố tăng trưởng biến đổi beta (TGF-β), tế bào gan. yếu tố tăng trưởng (HGF) hoặc yếu tố tăng trưởng giống insulin-1 (IGF-1), hoạt động bằng cách thúc đẩy quá trình tái tạo xương và ngăn ngừa mất xương (17). Ngoài tế bào MSC có nguồn gốc từ tủy xương hay mô mỡ, tế bào gốc trung mô phân lập từ tủy răng sữa (SHED) là một trong những nguồn cung cấp tế bào gốc MSC để điều trị loãng xương. Tế bào SEHD ngoài những tính chất của tế bào gốc MSC như khả năng hình thành tế bào xương, sụn và mỡ còn có ưu thế trong việc phân lập mà không cần xâm lấn như mô mỡ hay tủy xương. Nghiên cứu của Kumar và cộng sự đã cho thấy tế bào MSC được phân lập từ tủy răng có khả năng tạo xương cao hơn hẳn các tế bào MSC được phân lập từ BM-MSC và khả năng tạo tế bảo mỡ của chúng cũng thấp so với các tế bào BM-MSC (18).
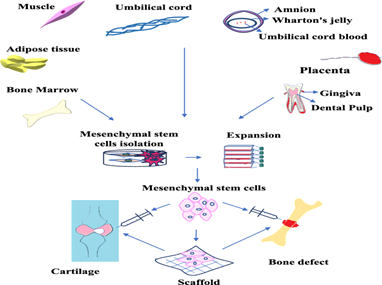
Các nguồn phân lập MSC từ tủy xương (bone marrow), Mỡ (Adipose tissue), Cơ (Muscle), dây rốn (Umbilical Cord), Tủy răng (Dental pulp) được nuôi cấy trước khi truyền
ỨNG DỤNG TẾ BÀO GỐC TỦY RĂNG SỮA TRÔNG ĐIỀU TRỊ LOÃNG XƯƠNG
Tiêm trực tiếp vào tủy xương và tiêm tĩnh mạch là những phương pháp phổ biến hiện nay cho nghiên cứu liệu pháp sử dụng tế bào gốc MSC trong điều trị loãng xương. Liu và cộng sự năm 2014 đã đánh giá khả năng sử dụng tế bào SHED để phòng bệnh loãng xương giai đoạn sớm ở trên chuột bị cắt tử cung, sử dụng tế bào SHED với liều lượng 2×106 tế bào qua tưởng tĩnh mạch đuôi. Kết quả thí nghiệm sau 3 tuần, hiện tượng apoptosis tế bào T được kích hoạt thông qua con đường Fas qua trung gian Fas ligand (FasL), dẫn đến điều chỉnh tăng các tế bào T điều hòa (Tregs) và giảm các tế bào Th1 và Th17 xuất hiện ở nhóm chuột sử dụng SHED. Phương pháp điều hòa miễn dịch qua trung gian SHED này giảm sự suy yếu do cắt tử cung gây ra đối với các tế bào gốc trung mô tủy xương (BMMSC) và kích hoạt quá trình tạo xương, dẫn đến tăng khối lượng xương. Tóm lại, apoptosis tế bào T qua trung gian SHED thông qua con đường FasL/Fas dẫn đến tăng khả năng dung nạp miễn dịch và cải thiện tình trạng loãng xương ở chuột bị cắt tử cung (19). Nghiên cứu của Sonoda và cộng sự năm 2020 đã sử dụng chất tiết ngoại bào từ tế bào SHED (SHED-EV) để điều trị loãng xương ở chuột đã bị cắt tử cung. Nhóm chuột nghiên cứu được tiêm 100 μg SHED-EV ở dưới da lưng, nhóm đối chứng còn lại được tiêm PBS. Kết quả đánh giá sau 3 tuần, nhóm chuột được sử dụng SHED-EV đã phục hồi thể tích xương, cải thiện chức năng của các tế bào MSC trong tủy xương so với nhóm chuột đối chứng (20). Nhóm nghiên cứu của Ma và cộng sự đã sử dụng tế bào SHED để điều trị cho chuột bị loãng xương thứ phát do bị lupus ban đỏ nhằm đánh giá vai trò của SHED trong quá trình tạo xương và cũng như ảnh hưởng của nó chức năng của tế bào MSC từ tủy xương của chuột được điều trị. Kết quả cho thấy việc sử dụng SHED giúp phục hồi tình trạng giảm mật độ và cấu trúc xương ở chuột thông qua việc ức chế IL-17, một interleukin ức chế sự hình thành xương của các tế bào BM-MSC ở những bệnh nhân bị lupus ban đỏ (21). Ở các thử nghiệm lâm sàng trên người cho đến hiện nay cho việc sử dụng MSC điều trị chủ yếu là tế bào MSC tự thân từ tủy xương (BM-MSC) hoặc AD-MSC tuy nhiên đều chưa công bố kết quả nghiên cứu. Bệnh viện Clinico Virgen de la Arrixaca ở Tây Ban Nha đã tiến hành một thử nghiệm lâm sàng sử dụng BM-MSC tự thân điều trị loãng xương ở giai đoạn I, các bệnh nhân được phân lập BM-MSC trước 30 ngày so với lần truyền đầu tiên. Bốn bệnh nhân sử dụng 1 liều tiêm tĩnh mạch duy nhất với 2×106 tế bào/kg cân nặng và 6 bệnh nhân cho được tiêm với liều 5×105 tế bào/kg cân nặng. Sau 24 tháng điều trị bệnh nhân đánh các chỉ số sinh hóa, đo hấp thụ tia X-kép (ClinicalTrials.gov Mã định danh: NCT02566655).
Tóm lại, việc sử dụng tế bào gốc tủy răng sữa SHED hoặc SHED-EV để điều trị loãng xương đã có kết quả đáng ghi nhận về khả năng phục hồi xương, ngăn chặn loãng xương tiến triển trên mô hình chuột. Tế bào gốc tủy răng sữa cũng được xem là một trong những nguồn phân lập MSC tiềm năng do có nhiều ưu điểm hơn so với các nguồn từ tự thân như BM-MSC hay AD-MSC. Tuy nhiên, còn cần chờ đánh giá đầy đủ chi tiết hơn về tính an toàn, quy trình sản xuất và hiệu quả điều trị của SHED ở các thử nghiệm điều trị lâm sàng trên người.
TÀI LIỆU THAM KHẢO
- Klibanski, A., Adams-Campbell, L., Bassford, T., Blair, S. N., Boden, S. D., Dickersin, K., … & Russell, W. E. (2001). Osteoporosis prevention, diagnosis, and therapy. Journal of the American Medical Association, 285(6), 785-795.
- Ebeling, P. R., Nguyen, H. H., Aleksova, J., Vincent, A. J., Wong, P., & Milat, F. (2022). Secondary osteoporosis. Endocrine Reviews, 43(2), 240-313.
- Sözen, T., Özışık, L., & Başaran, N. Ç. (2017). An overview and management of osteoporosis. European journal of rheumatology, 4(1), 46.
- Reginster, J. Y., Neuprez, A., Dardenne, N., Beaudart, C., Emonts, P., & Bruyere, O. (2014). Efficacy and safety of currently marketed anti-osteoporosis medications. Best Practice & Research Clinical Endocrinology & Metabolism, 28(6), 809-834.
- Aghebati‐Maleki, L., Dolati, S., Zandi, R., Fotouhi, A., Ahmadi, M., Aghebati, A., … & Yousefi, M. (2019). Prospect of mesenchymal stem cells in therapy of osteoporosis: a review. Journal of cellular physiology, 234(6), 8570-8578.
- Liu, Y., Luo, D., & Wang, T. (2016). Hierarchical structures of bone and bioinspired bone tissue engineering. Small, 12(34), 4611-4632.
- Salhotra, A., Shah, H. N., Levi, B., & Longaker, M. T. (2020). Mechanisms of bone development and repair. Nature reviews Molecular cell biology, 21(11), 696-711.
- Curtis, E. M., Dennison, E. M., Cooper, C., & Harvey, N. C. (2022). Osteoporosis in 2022: Care gaps to screening and personalised medicine. Best Practice & Research Clinical Rheumatology, 36(3), 101754.
- Aibar-Almazán, A., Voltes-Martínez, A., Castellote-Caballero, Y., Afanador-Restrepo, D. F., Carcelén-Fraile, M. D. C., & López-Ruiz, E. (2022). Current status of the diagnosis and management of osteoporosis. International journal of molecular sciences, 23(16), 9465.
- Heilmeier, U., Youm, J., Torabi, S., & Link, T. M. (2016). Osteoporosis imaging in the geriatric patient. Current radiology reports, 4, 1-13.
- Haasters, F., Docheva, D., Gassner, C., Popov, C., Böcker, W., Mutschler, W., … & Prall, W. C. (2014). Mesenchymal stem cells from osteoporotic patients reveal reduced migration and invasion upon stimulation with BMP-2 or BMP-7. Biochemical and Biophysical Research Communications, 452(1), 118-123.
- Rodríguez, J. P., Montecinos, L., Ríos, S., Reyes, P., & Martínez, J. (2000). Mesenchymal stem cells from osteoporotic patients produce a type I collagen‐deficient extracellular matrix favoring adipogenic differentiation. Journal of cellular biochemistry, 79(4), 557-565.
- Wang, Y., Song, W., Jing, S., & Yu, J. (2014). Effect of estrogen deficiency on the proliferation and osteogenic differentiation potential of mandibular bone marrow stromal cells. Zhonghua kou Qiang yi xue za zhi= Zhonghua Kouqiang Yixue Zazhi= Chinese Journal of Stomatology, 49(10), 619-624.
- Stolzing, A., Jones, E., Mcgonagle, D., & Scutt, A. (2008). Age-related changes in human bone marrow-derived mesenchymal stem cells: consequences for cell therapies. Mechanisms of ageing and development, 129(3), 163-173.
- Zhou, S., Greenberger, J. S., Epperly, M. W., Goff, J. P., Adler, C., LeBoff, M. S., & Glowacki, J. (2008). Age‐related intrinsic changes in human bone‐marrow‐derived mesenchymal stem cells and their differentiation to osteoblasts. Aging cell, 7(3), 335-343.
- Dominici, M. L. B. K., Le Blanc, K., Mueller, I., Slaper-Cortenbach, I., Marini, F. C., Krause, D. S., … & Horwitz, E. M. (2006). Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy, 8(4), 315-317.
- Phetfong, J., Sanvoranart, T., Nartprayut, K., Nimsanor, N., Seenprachawong, K., Prachayasittikul, V., & Supokawej, A. (2016). Osteoporosis: the current status of mesenchymal stem cell-based therapy. Cellular & molecular biology letters, 21(1), 1-20.
- Kumar, A., Kumar, V., Rattan, V., Jha, V., & Bhattacharyya, S. (2018). Secretome proteins regulate comparative osteogenic and adipogenic potential in bone marrow and dental stem cells. Biochimie, 155, 129-139.
- Liu, Y., Wang, L., Liu, S., Liu, D., Chen, C., Xu, X., … & Shi, S. (2014). Transplantation of SHED prevents bone loss in the early phase of ovariectomy-induced osteoporosis. Journal of dental research, 93(11), 1124-1132.
- Sonoda, S., Murata, S., Nishida, K., Kato, H., Uehara, N., Kyumoto, Y. N., … & Yamaza, T. (2020). Extracellular vesicles from deciduous pulp stem cells recover bone loss by regulating telomerase activity in an osteoporosis mouse model. Stem Cell Research & Therapy, 11, 1-16.
- Ma, L., Aijima, R., Hoshino, Y., Yamaza, H., Tomoda, E., Tanaka, Y., … & Yamaza, T. (2015). Transplantation of mesenchymal stem cells ameliorates secondary osteoporosis through interleukin-17-impaired functions of recipient bone marrow mesenchymal stem cells in MRL/lpr mice. Stem Cell Research & Therapy, 6, 1-17.
