Điều trị bệnh lupus ban đỏ bằng tế bào gốc trung mô
Bệnh tự miễn hệ thống là do phản ứng miễn dịch bất thường gây ra tình trạng viêm và tổn thương các mô hoặc các cơ quan đích như da, thận, khớp, và cơ [1]. Lupus ban đỏ hệ thống (SLE) là một bệnh tự miễn đa hệ thống, gây ra tổn thương đa cơ quan, và có khả năng gây tử vong, đặc trưng bởi sự hoạt hóa và tăng sinh của các tế bào T và tế bào B [2]. Điều trị SLE là một thách thức vì sự không đồng nhất về mặt lâm sàng và việc tái mắc bệnh không thể đoán trước được. Một số loại thuốc đã được nghiên cứu tuy nhiên thường hay gây ra nhiều tác dụng phụ trong và sau khi ngừng thuốc. Tế bào gốc trung mô (MSC) có khả năng ức chế miễn dịch mạnh mẽ. Do đó, cấy ghép MSCs đã nổi lên như một liệu pháp có lợi tiềm năng cho các bệnh tự miễn dịch đặc biệt là bệnh SLE.
TẢI FILE PDF TẠI ĐÂY: Điều trị lupus ban đỏ bằng tế bào gốc trung mô – PDF
Liên hệ với chúng tôi ngay để điều trị bệnh Lupus ban đỏ bằng liệu pháp tế bào gốc cuống rốn 0937 53 45 45
Điều trị bệnh Lupus ban đỏ theo các phác đồ có sử dụng thuốc thuộc loại corticosteroid hay loại chống viêm giảm đau.
Lupus ban đỏ hệ thống (SLE) là một bệnh tự miễn hệ thống ở giai đoạn cuối thường gây nhiều biến chứng tới các cơ quan như biến chứng tại tim, phổi, thận, thần kinh, và hệ tạo máu. Tùy thuộc vào biến chứng, chúng ta có thể sử dụng các loại thuốc chống viêm như Ibuprofen, Aspirin, prednisone, chloroquine, methotrexate, tacrolimus, và azathioprine đã cải thiện đáng kể sự sống sót của bệnh nhân SLE [3]. Tuy nhiên chúng thường gây ra các tác dụng phụ như loét dạ dày, loãng xương, tăng nguy cơ nhiễm trùng, ức chế tủy xương, và bệnh có khả năng tái phát sau khi ngừng thuốc [4].
Liệu pháp thông thường thường yêu cầu sử dụng nhiều thuốc ức chế miễn dịch trong vài năm hoặc thậm chí suốt đời của bệnh nhân, không chỉ ảnh hưởng đến cuộc sống hàng ngày của bệnh nhân mà còn làm nặng thêm gánh nặng tài chính và tâm lý của bệnh nhân. Do đó, chúng ta vẫn cần có những liệu pháp mang tính hiệu quả và an toàn hơn trong tương lai. Một trong những liệu pháp đó là sử dụng tế bào gốc trung mô (MSC), do đặc tính điều hòa miễn dịch và tái tạo của của MSC. Đây có thể là phương pháp điều trị mới rất cần thiết đối với những bệnh nhân đáp ứng kém với liệu pháp thông thường, liệu pháp MSC đã cho thấy hiệu quả khả quan với các tác dụng phụ liên quan đến điều trị có thể chấp nhận được và là một liệu pháp an toàn và hiệu quả [5]. Các đặc tính và hiệu quả điều trị của MSC khiến chúng trở thành một liệu pháp đầy hứa hẹn trong điều trị SLE.
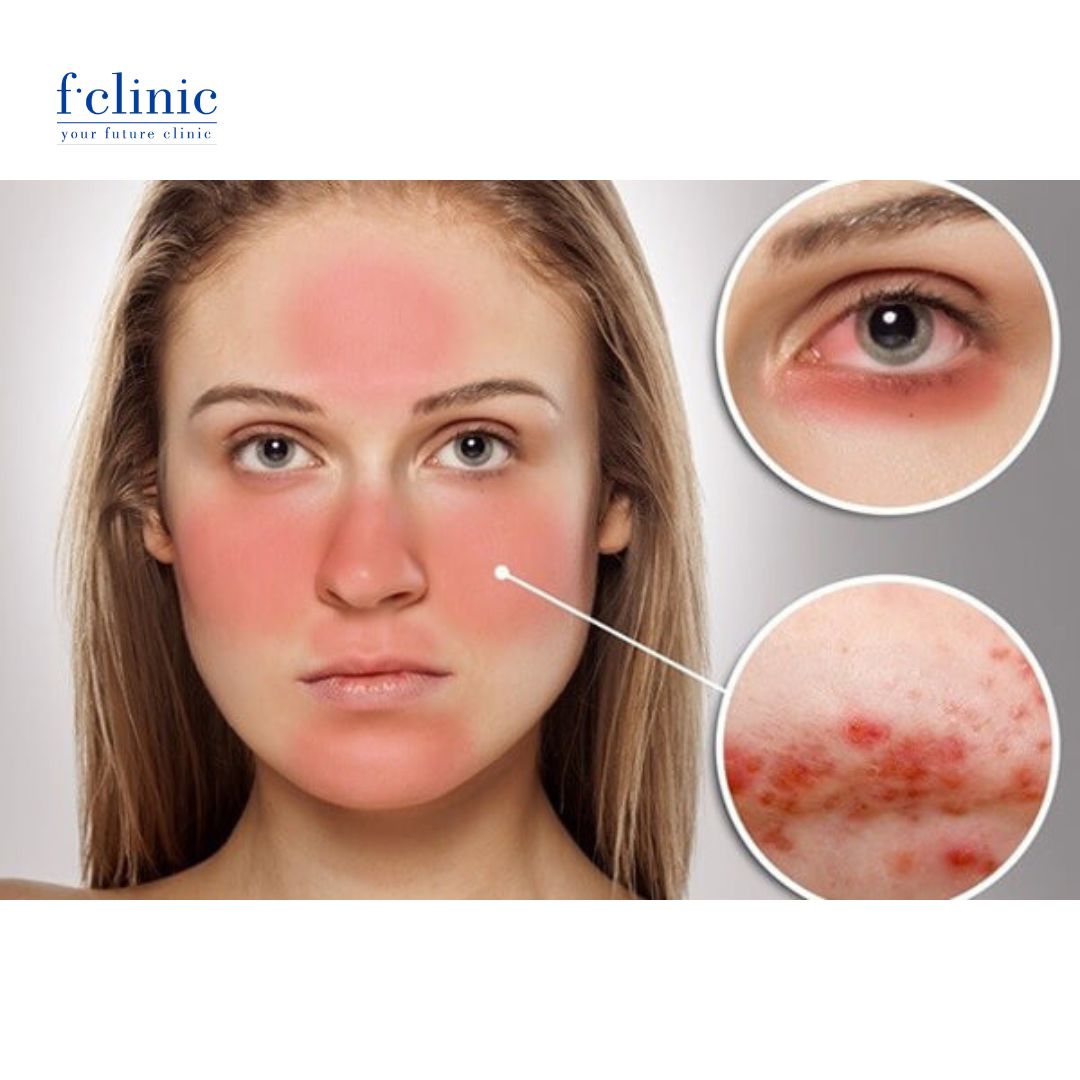
Lupus ban đỏ hệ thống thường được gọi đơn giản là bệnh lupus, được mô tả lần đầu tiên vào năm 1845 bởi Hebra. Đây là một bệnh tự miễn mạn tính, không rõ nguyên nhân, gây tổn thương hầu hết các hệ cơ quan trong cơ thể và trong trường hợp nặng, có thể đe dọa tính mạng người bệnh.
Ưu điểm và triển vọng của việc điều trị SLE bằng MSC
MSC là các tế bào gốc đa năng, tự tái tạo có thể biệt hóa thành các tế bào chuyên biệt trưởng thành khác nhau. MSC có thể điều chỉnh cả hệ thống miễn dịch thích ứng ở những bệnh nhân mắc bệnh tự miễn [6]. MSC được cấy ghép đồng loài từ những người khỏe mạnh không có tiền sử bệnh tự miễn đem lại hiệu quả cao với bệnh nhân SLE và có thể cải thiện các triệu chứng bệnh SLE ở những bệnh nhân đó. Ngược lại, MSC tự thân từ bệnh nhân SLE không có hiệu quả ức chế miễn dịch và không cải thiện các triệu chứng của bệnh do MSCs bị rối loạn chức năng cả về tăng sinh và điều hòa miễn dịch. Ngoài ra, bênh SLE cũng biểu hiện sự cân bằng điều tiết nội môi trong cơ thể do tính kiểm soát tự miễn dịch bị mất. Chìa khóa của vấn đề đó bởi sự hoạt động bất thường của Tregs. Treg hoạt động bằng cách điều chỉnh giảm sự kích hoạt và tăng sinh của tế bào T tác động [7], việc ghép MSC đồng loài có thể khôi phục mức cân bằng của Treg ở bệnh nhân SLE.
Trong những năm gần đây, các quốc gia trên thế giới đã và đang rất coi trọng việc nghiên cứu tế bào gốc và áp dụng trên lâm sàng. Số lượng thử nghiệm lâm sàng cho các liệu pháp tế bào gốc cho các bệnh tự miễn được đăng ký trên trang web www.clinicaltrials.gov đã trên 200 trường hợp hầu hết là MSC hoặc tế bào gốc tạo máu (HSC). Truyền HSC tự thân cũng khôi phục số Treg và chức năng ức chế miễn dịch ở bệnh nhân SLE [8]. Sự thành công của các liệu pháp HSC tự thân đã khuyến khích việc sử dụng MSCs để điều trị cho bệnh nhân SLE. Một số nghiên cứu lâm sàng đã được thực hiện để đánh giá hiệu quả lâm sàng tiềm năng của việc cấy ghép MSC như một phương pháp điều trị thay thế cho liệu pháp dược lý hiện tại cho SLE.
Đáng chú ý, các nghiên cứu trước đây đã chỉ ra rằng MSCs có khả năng ức chế sự tăng sinh và biệt hóa của tế bào B [9] và do đó có thể có hiệu quả đầy hứa hẹn trong điều trị SLE. MSC đã được nghiên cứu và ứng dụng chuyên sâu trong y học tái tạo và kỹ thuật mô. Gần đây, các chức năng điều biến miễn dịch của chúng làm cho chúng trở thành phương pháp tiếp cận tiềm năng hấp dẫn để điều trị bệnh tự miễn dịch.
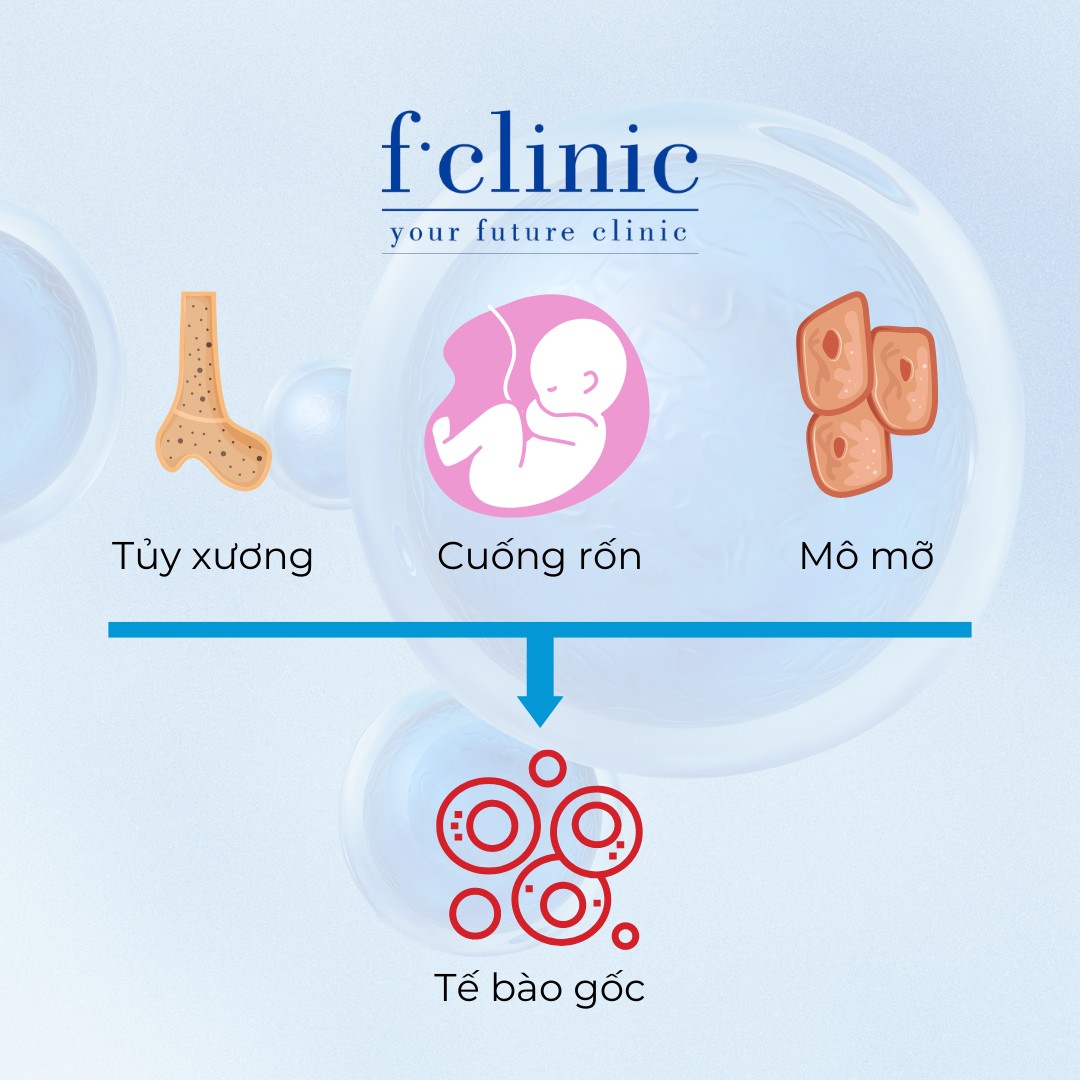
Nguồn tế bào gốc trung mô có chất lượng tốt nhất là từ cuống rốn em bé
Hiệu quả lâm sàng và tính an toàn của tế bào gốc trung mô từ máu cuống rốn đối với bệnh Lupus ban đỏ hệ thống
MSC từ cuống rốn, chúng có thể được thu hoạch một cách an toàn mà không có mối lo ngại lớn nào về mặt đạo đức. Cho đến nay, MSCs đã được ứng dụng thành công trong điều trị nhiều bệnh tự miễn, trong đó có bệnh SLE [10]. MSCs đã được nghiên cứu để thúc đẩy quá trình kết hợp HSC và ngăn ngừa thải ghép [11]. Và việc cấy ghép MSC có nguồn gốc từ dây rốn đã cho thấy hiệu quả ở những bệnh nhân mắc các bệnh tự miễn, đặc biệt là bệnh SLE [12]. MSC từ máu cuống rốn có thể ức chế sự tăng sinh tế bào T ở bệnh nhân lupus bằng cách tiết ra một lượng lớn indoleamine 2,3-dioxygenase [13]. Chúng cũng ngăn chặn sự tăng sinh và biệt hóa của tế bào B ở bệnh nhân SLE. Như chúng ta đã biết, tế bào T được kích hoạt một cách đặc trưng ở những bệnh nhân bị SLE, đặc biệt là ở những người có ở thể nặng. Do đó, điều chỉnh trạng thái năng lượng của tế bào T có thể là một cách mới để điều trị bệnh nhân SLE.
Như vậy, tiềm năng điều trị bệnh SLE bằng MSC nói chung và MSC từ cuống rốn nói riêng là rất có triển vọng, chúng đem lại không những về mặt sinh học nhằm cải thiện chất lượng cuộc sống của bệnh nhân mà còn đem lại nhiều lợi ích về mặt tài chính cho bệnh nhân nói riêng và cho toàn xã hội nói chung. Tuy vẫn còn nhiều hạn chế trong việc nghiên cứu sâu hơn cơ chế của MSC đối với bệnh SLE và thời gian nghiên cứu dài hơn nhằm đánh giá hiệu quả tổng thể của MSC. Nhưng liệu pháp MSC vẫn được coi là bước tiến mới trong việc điều trị bênh SLE.
ĐẶT LỊCH TƯ VẤN ĐIỀU TRỊ TẠI NƯỚC NGOÀI
Điện thoại
0937 53 45 45
info.fclinic@gmail.com
Tài liệu tham khảo
- Fanouriakis, Antonis, Nikolaos Tziolos, George Bertsias, and Dimitrios T. Boumpas. “Update οn the diagnosis and management of systemic lupus erythematosus.” Annals of the rheumatic diseases 80, no. 1 (2021): 14-25.
- Lee, Y. H., S. J. Choi, J. D. Ji, and G. G. Song. “Overall and cause-specific mortality in systemic lupus erythematosus: an updated meta-analysis.” Lupus 25, no. 7 (2016): 727-734.
- Hahn, Bevra Hannahs. “Belimumab for systemic lupus erythematosus.” New England Journal of Medicine 368, no. 16 (2013): 1528-1535.
- Bernatsky, S., J‐F. Boivin, L. Joseph, S. Manzi, E. Ginzler, D. D. Gladman, M. Urowitz et al. “Mortality in systemic lupus erythematosus.” Arthritis & Rheumatism: Official
- Journal of the American College of Rheumatology 54, no. 8 (2006): 2550-2557.
- Wang, Dandan, Lingying Niu, Xuebing Feng, Xinran Yuan, Shengnan Zhao, Huayong Zhang, Jun Liang et al. “Long-term safety of umbilical cord mesenchymal stem cells transplantation for systemic lupus erythematosus: a 6-year follow-up study.” Clinical and Experimental Medicine 17, no. 3 (2017): 333-340.
- Munir, Hafsa, and Helen M. McGettrick. “Mesenchymal stem cell therapy for autoimmune disease: risks and rewards.” Stem cells and development 24, no. 18 (2015): 2091-2100.
- Li, Ming O., and Alexander Y. Rudensky. “T cell receptor signalling in the control of regulatory T cell differentiation and function.” Nature Reviews Immunology 16, no. 4 (2016): 220-233.
- Zhang, Li, Anne M. Bertucci, Rosalind Ramsey-Goldman, Richard K. Burt, and Syamal K. Datta. “Regulatory T cell (Treg) subsets return in patients with refractory lupus following stem cell transplantation, and TGF-β-producing CD8+ Treg cells are associated with immunological remission of lupus.” The Journal of Immunology 183, no. 10 (2009): 6346-6358.
- Corcione, Anna, Federica Benvenuto, Elisa Ferretti, Debora Giunti, Valentina Cappiello, Francesco Cazzanti, Marco Risso et al. “Human mesenchymal stem cells modulate B-cell functions.” Blood 107, no. 1 (2006): 367-372.
- Liao, Jieyue, Christopher Chang, Haijing Wu, and Qianjin Lu. “Cell-based therapies for systemic lupus erythematosus.” Autoimmunity reviews 14, no. 1 (2015): 43-48.
- Gao, Lei, Yan-Qi Zhang, Jia Liu, Shi-Feng Lou, Yi Su, Tong-Hua Yang, Hui-Min Li et al. “Phase II multicenter, randomized, double-blind controlled study of efficacy and safety of umbilical cord-derived mesenchymal stromal cells in the prophylaxis of chronic graft-versus-host disease after HLA-haploidentical stem-cell transplantation.” (2016).
- Wang, Dandan, Jing Li, Yu Zhang, Miaojia Zhang, Jinyun Chen, Xia Li, Xiang Hu, Shu Jiang, Songtao Shi, and Lingyun Sun. “Umbilical cord mesenchymal stem cell transplantation in active and refractory systemic lupus erythematosus: a multicenter clinical study.” Arthritis research & therapy 16, no. 2 (2014): 1-14.
- Wang, Dandan, Xuebing Feng, Lin Lu, Joanne E. Konkel, Huayong Zhang, Zhiyong Chen, Xia Li et al. “A CD8 T cell/indoleamine 2, 3‐dioxygenase axis is required for mesenchymal stem cell suppression of human systemic lupus erythematosus.” Arthritis & rheumatology 66, no. 8 (2014): 2234-2245.
